Это копия, сохраненная 8 июня 2018 года.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
Кто хочет вспомнить химию или ищет книгу - тут вот посоветовали "Общая химия. Глинка Н.Л".
Скачать в PDF можно здесь (44,1 МБ): http://www.200ballov.com.ua/files/chem/glinka.pdf
Вот пару картинок с таблицами Менделеева. Пик4 - цикл Кребса.
Вот ещё пикча побольше, кому для плакатов - она сюда просто не лезет:
http://ogoom.com/uploads/posts/2011-05/ogoom.com_1305370963_mendeleev1.jpg
Также оставлю здесь расширенную таблицу химических элементов, где есть даже Унбигексий:
https://ru.wikipedia.org/wiki/Расширенная_периодическая_таблица_элементов
И ссылку на таблицу нуклидов на английской википедии, там видно типы распадов:
https://en.wikipedia.org/wiki/Table_of_nuclides_(segmented,_narrow)
https://en.wikipedia.org/wiki/Category:Lists_of_isotopes_by_element
Потому что здесь: https://ru.wikipedia.org/wiki/Таблица_нуклидов
По каждому конкретному элементу это поле нужно допиливать.
https://ru.wikipedia.org/wiki/Шаблон:Периодическая_таблица_по_изотопам_элементов
Вот, например можно сравнить внизу таблицы:
https://ru.wikipedia.org/wiki/Изотопы_кислорода
https://en.wikipedia.org/wiki/Isotopes_of_oxygen - тут видно тип распада, каналы распада и вероятность.
И сразу вопрос: стабильность перекиси водорода. Википедия говорит, что почти чистая перекись очень стабильная, но в то же время говорят 90% перекись взрывается от лёгкого механического воздействия. Кому верить? Насколько стабильна перекись 50-80%? Ебанет при перегрузке в 2g?
Фон Браун, залогиньтесь.
И научитесь гуглить. Стабильность перекиси водорода зависит не только и не столько от концентрации, там куча факторов.
>перекись взрывается
Чё-это она должна сама по-себе взрываться? Она и так окислена.
Вот если туда бросить какое-то горючее, то да, в выделяющемся атомарном кислороде,
который более активен, оно может и взорваться (если его дофига этого атомарного кислорода).
Там кислород выделяется, конечно взрывается.
Не прогуливать химию. Кхе кхе.
А вообще это самый важный вопрос теоретической химии, и ты ждешь какой-то простой ответ? Или тебе надо развернутый?
Наверное можно. Но можно пример поконкретнее. Я не понял определения "перепрелись".
Молекула с молекулой. Очевидно же
Нужны программы, которые решают такие задачи: поиск нужного с заданными свойствами, генерит инструкцию из чего можно получить заданную формулу.
Ну изначально всё упирается в строение атома и квантовую химию. Надо спросить вообще почему молекула именно такая и не разваливаются атомы. А потом уже думать, что будет при их столкновениях. Но и столкновения можно посчитать. Часто выгодно поменять строение, ведь это даст выигрыш в энергии. Во многих реакциях путей соединиться много, тут вступает статистика. Статистика в применении к химии, называется химическая термодинамика, она поясняет, что и как устойчивее будет соединяться. Но зачастую, всё идет не так, как предполагает устойчивость, ведь важна еще скорость. Тут вступает в силу кинетика. Часто при столкновении молекул, недостаточно энергии, чтобы преодолеть отталкивание их друг от друга, например смесь бытового газа и кислорода, вполне себе живет и не горит. Хотя выгоднее будет тупо взорваться, как только температура повышается, то каким-то молекулам уже достаточно энергии, чтобы при столкновении атомы подошли достаточно близко, чтобы начать менять свои строения. Это можно сравнить как перекатывание мяча через горку. Если недостаточно пнуть мяч, он просто скатится обратно тебе в руки.
Есть такие таблицы. Там данные по теплоемкостям, по энтропии и по энтальпии веществ.
Поисковые системы, очевидно же.
Шалом, ананасы.
И сразу тупой вопрос: от чего зависят стандартные энтальпии образования веществ?
Тупо таблички с данными не подходят.
Можете просто метнуть в меня книжкой, буду благодарен.
Кек. Ну по определению посмотри. Это тупо энтальпия образования одного моль, из простых веществ в стандартных состояниях. Фактически зависит от прочностей связей.
Школьникберг?
Вопрос некорректный. Переформулируй.
>генерит инструкцию из чего можно получить заданную формулу
Я не думаю, что это бесплатно. Есть SciFinder и Reaxys. Если ты не можешь позволить себе их, то остается гуглить (буквально) их синтез или исходить из общих соображений.
Из чего делают чернила для пометки взяток?
> Это тупо энтальпия образования одного моль, из простых веществ в стандартных состояниях.
Вообще не то, о чем я спрашивал, но да ладно.
>Фактически зависит от прочностей связей.
А вот это меня и интересовало, спасибо.
 28 Кб, 604x284
28 Кб, 604x284Ты книжку найти не можешь, в 2к17, какая тебе химия? Иди учись мобилками торговать.
ХЕХ блядь. Чифиру навернул уже, урод?
Прочитай учебник по криминологии если хочешь научиться полезным вещам.
>Вследствие повышения температуры газы расширяются, и, в общем, 1 см жидкой перекиси водорода дает при разложении 7000 сж раскаленных газов. Так как разложение происходит мгновенно с расширением в 7000 раз, то происходит весьма опасный взрыв. Щито?
Какая там энергия должна быть, pаз аж такой объем газа выходит?
>При разложении моль перекиси, выходит 54кДж тепла где-то.
А куда оно денется? Уйдет на нагpев всего и вся?
Хм, 1 моль будет 34 гpамма, выйдет 11,2 литpа кислоpода При разложении моль перекиси, выходит 54кДж тепла где-то.
Хм, там навеpное и пpавда гpадусов 500-700 будет, лень уpавнения школьные вспоминать.
Видимо куча энергии расходуется на нагрев воды. В реальных движках туда еще и топливо добавляли.
 7 Кб, 443x93
7 Кб, 443x93Предел текучести при температуре 25 0С у чистого железа 50 МПа. Если чистое железо засунуть в атмосферу давление которого 50 МПа и охладить до 25 0С, то оно(чистое железо) изменит свойства? Станет мягким как пластилин, или текучей жидкостью? А что будет с чистым железом если засунуть в атмосферу давление которого равно пределу разрыва? Станет атомарным газом?
Я не особо шарю куда обратиться, поэтому написал сюда, ибо это самый близкий тред по теме, что я нарыл. Итак, мне нужно достать оксиды некоторых д-элементов для опыта. Сколько я не искал — нихуя толкового нету. В основном они продаются тоннами или оптом по кг, но мне надо не больше 100 г каждого, ну или хотя бы 1 кг, если оно не стоит по 30-50 бачей. КАК НАЙТИ ГОДНЫЙ МАГАЗИН РЕАКТИВОВ С ДОСТАВКОЙ В ХОХЛЕНД (ЕСЛИ МАГАЗ САМ В В УКРАИНЕ ВАЩЕ ЗАБИСЬ).
ПРОШУ ХЕЛП!!!!
Доступно, понятно, можно спросить у марьи семеновны в учебном заведении.
А так книжка конечно устарела, спору нет.
Так с физиками же не работает? Не говоря уж о ценах.
Кстати, не знает кто-нибудь конторы, которая может (с наценкой) заказать для тебя что-то в сигме или еще где?
Что именно ты хочешь узнать?
>почему в воде 2 атома водорода и соединяются с одним кислорода забыл уже
Это теория октетов Льюиса. Она изложена в той же "Неорганической химии" Хьюи.
Она пpи pазложении кучу энергии выделяет, вот и получается взpыв.
Нет, товарищ майор. Только упариванием при комнатной температуре под вакуумом.
Есть даун который помоежт мне с химией по скайпу дискорду ?
с меня как всегда нихуя
Шалом. Я за советом.
Есть вся школьная программа на идеальном егэ 100 уровне, хочу ещё. Интересует теоретическая химия, органика. Глинками попрошу не кидаться.
Три тома неорганической химии Третьякова, как закуска.
Потом двухтомник Химии элементов Гринвуда, чтобы смазать.
Параллельно куришь Хьюи Теоретическая неорганическая химия. И Хаускрофта.
Органику читаешь то что тебе посоветовали, плюс четырехтомник Курц Реутов. Очень теоретизированная книга.
Ах да, еще Клейдена органику.
И тебе спасибо.
>Потом двухтомник Химии элементов Гринвуда, чтобы смазать.
Ты постебался над ним? Это сборник статей каких-то, причем не самый лучший.
Сколько заплатиш?
И зачем ты вообще пошел в химию если ты там ноль и тебе этим не в кайф заниматься?
Будто химию можно узнать кроме как из лабы или чтением статей. На бумаге в учебнике, всегда всё слишком идеально.
Мне нужна мембрана для генерации азота производительностью около 1 литра в минуту не менее 95%-й чистоты из воздуха. Готовые генераторы не по карману. Поэтому желаю смастерить самостоятельно. Поиск не помог. Есть наводки?
Для чего? — для пайки бессвинцовым припоем. Территориально нахожусь в России, физлицо. По сумме, которую готов затратить на приобретение — не определился.
учебник
Есть порошок с подмешанным галоперидолом. Как отбить галку?
>Есть вся школьная программа на идеальном егэ 100 уровне, хочу ещё. Интересует теоретическая химия, органика
Нахуя? Для получения корочки с целью дальнейшего трудоустройства нужно идти в ВУЗ-ы, а не ковыряться в книгах. Если ты думаешь, что предварительное чтение книг тебе как-то поможет, то ты ошибаешься: институтские програмы обычно имеют мало чего общего с реальностью, потому шансов попасть в цель у тебя очень мало.
Если ты хочешь узнать больше о превращениях веществ, то тебе нужна практика - можно даже ничего не читать толком, а просто консультироваться периодически с опытными челами.
>>27064
>Мне нужна мембрана для генерации азота производительностью около 1 литра в минуту не менее 95%-й чистоты из воздуха
Там разве не цеолиты 3Å? Как ты собрался проверять чистоту полученного газа? Анон правильно пишет - купи готовый.
У мета 2 изомера оптических. D и L. Сделать смесь 50 на 50 легко. D лучше в 3-4 раза. Он же как я понимаю делал 96% именно D и 4% L.
Закон теплопередачи вроде везде проходят. Там логарифм выходит в формулах.
>Точно так же и чай быстрей охладится если его немного подержать горячим, чем если сразу после кипятка влить в него холодное молоко?
именно
>>27181
> покупай готовый
Вопрос именно о мембранном разделение газов на полимере с низкой производительностью.
Нашёл пару поставщиков, но даже, например, у http://www.globalspec.com/ слишком производительные и габаритные трубки. Ищу ещё меньше.
Для примера оставлю ссылки на оконечное оборудование(без подачи смеси) http://www.goot.jp/en/handakote/nc-100r/
http://www.hakko.com/english/products/hakko_fx780.html
 2,9 Мб, 1920x1080
2,9 Мб, 1920x1080Лоол, я ему в комментах писал где он делал урию что ему надо попробовать на вкус.
Да изи. Это же не мерзко даже.
Какая температура плавления у сандракопимаровой кислоты? Давно органическую химию не изучал. Хоть примерно подскажите. Там же есть какое-то правило по температуре плавления чётных и нечётных кислот?
Можно выделить хотя бы эвтектическую смесь с ней в домашних условиях без специальных приспособлений?
Где можно приобрести пимаровую кислоту в небольшом количестве, грамм пять самый максимум? Знает кто её температуру разложения?
Температура плавления верная 161°С ? И вроде как чистую её не получить.
Мне нужно составить список смоляных кислот с температурных ранжированием плавления в диапазоне от 150 до 300 градусов цельсия. В идеале и температуры их деструкции при обычном атмосферном давлении.
Спасибо
>хочу ещё
Идешь в ближайший НИИ, договариваешься на роль лабораторной мартыхи забесплатно. Там тебе все пояснят по хардкору, научат кое-как ставить синтезы, также получишь доступ к библиотеке нормальной литературы.
Так ну это понятно. А чтоб разнюхать кто там у кого чего отжал мне придётся залипать в таблицу(причём не Менделеева а растворимости наверно? Или как её?) подписывать сверху циферки и рисовать какие-то таблички? Или какие читы есть?
Hakko fx780 - самое адекватное решение, 1.5 л/мин, меньше ты вряд ли найдешь. Если ты расчитываешь на бюджет 10-20 тыс рублей, то покупай готовый в балонах.
Стоимость генераторов азота содержит в себе затраты на их разработку, при этом спрос на эти девайсы не такой большой, потому дешевых ты не найдешь.
>>28016
>Идешь в ближайший НИИ, договариваешься на роль лабораторной мартыхи забесплатно. Там тебе все пояснят по хардкору, научат кое-как ставить синтезы, также получишь доступ к библиотеке нормальной литературы.
Или закупаешь простейшие реактивы и оборудование, нормальный доступ к библиотеке есть у всех людей мира, кроме людей с рашкинскими IP, благодаря sci-hub.
>>28019
Если ты не можешь в сложную логическую информацию, то тебе нечего делать в химии вообще.
>Если ты не можешь в сложную логическую информацию, то тебе нечего делать в химии вообще.
Ну зачем ты так. Можешь хотябы ткнуть носом в книжку где нормально разжёвано. Глинка?
Прост когда училка объясняла я продвачевал
А учебник говно какое-то там кроме общей инфы нихуя нет. Помнится даже училка сказала что учебники хуёвые вам предлагают, а я мол заебись объясню поэтому слушайте внимательно. (А я дебил неповерил)
Аноньчик, когда я прочитал свою первую книжку, которую я, к слову, затаскал к хуям и у нее отвалилась обложка, то я в ней нихуя не понял, но выглядело это как книжка по магии для меня: ткани, мыло, пластмасы, взрывчатки, ускорение созревания фруктов. Когда ты смешиваешь два вещества, читаешь заклинание, всё начинает шипеть и от веществ не остается следа. В детстве малышней многие открыли для себя карбид кальция, который шипел, когда на него плюнешь. Как он шипит? Из него какие-то духи выходят?
Когда ты учишься ходить, то ты не сидишь не перебираешь книжки "вот здесь позы проще, а вот здесь сложновато для меня пока что будет", ты вообще не читаешь книжки - ты пытаешься приобрести навыки, опыт. Вокруг меня куча химиков, и большинство из них - конченые дауны, с которыми у нас мало чего общего и им безконечно далека магия, они просто выполняют инструкции, пока волосы не поседеют и их не вынесут из института под руки или в гробу.
Твоя училка - тупая мясная дырка без мужа и детей, которая в жизни своей приобрела хоби - учить всех как нужно жить. Больше, собсна, они нихуя не умеет, и даже в своей химии она сядет в лужу после некоторых моих вопросов, ответов на которые нет в учебниках.
 57 Кб, 405x309
57 Кб, 405x309пикрил
>пимаровую кислоту в небольшом количестве, грамм пять самый максимум?
Изомер - 50к за 25мг https://www.sigmaaldrich.com/catalog/product/sigma/i6783?lang=en®ion=RU
Слева температура плавления? Можно ссылку на этот список?
Очень большая цена за кислоту. Тем паче мне не нужна её высокая чистота. Согласен даже на грязную или в смеси с рядом стоящими по температуре плавления.
Это всё конечно здорово, но мне просто надо было в ОВР разобраться.
Собственно как оказалось для этого просто надо было загуглить как расставить степень окисления. Ну и это прочитать >>28012
>она сядет в лужу после некоторых моих вопросов, ответов на которые нет в учебниках.
О а можно пример? Прост интересно
Да он что-то видимо практическое имел ввиду. Хотя на самом деле, школьная программа настолько скудна и по теории, что пиздец. Помню, моя затирала училка про четверную связь в молекуле C2. Я скрипел зубами и больше не появлялся на уроках никогда. Вообще никогда. Нахуй её.
>Слева температура плавления? Можно ссылку на этот список?
Книга Identification of Lichen Substances Авторы: Siegfried Huneck,Isao Yoshimura на стр. 114, можешь найти в гугле по запросу "sandaracopimaric acid 163". Сама книга вроде есть на этом сервисе http://b-ok.org/s/?q=Identification+of+Lichen+Substances&yearFrom=&yearTo=&language=&extension=&t=0 только заходить надо через тор.
Для наколеночного электролиза лучше взять графит из твёрдого карандаша верно? Или всёже из мягкого?
Стержень из батарейки.
Лучше идти работать водителем или менеджером в банк.
Есть ли годная научно-популярная литература средней сложности о психоактивных веществах? Чтоб достаточно подробно разбирались механизмы действия, но чтоб всё-таки не Шульгина в оригинале читать, а что-то более "обзорное".
Вопросы, на которые я хочу (в числе прочего) получить ответы при прочтении:
1. У всех ли этих веществ есть какое-то общее свойство обусловленное "формой молекулы" или т.п., позволяющее веществам преодолевать гематоэнцефалический барьер или механизмы разные?
2. Почему десятки различных в химическом смысле фенилэтиламинов и триптаминов оказываются психоактивными? Что именно их объединяет?
3. После ответа на предыдущий вопрос: если психоактивными их делает вот это вот объединяющее свойство, то почему эффекты оказываются существенно разными?
4. Какие рецепторы на них реагируют? Почему?
5. Ну и общий экскурс в историю и т.п.
>заходить надо через тор
Хреновый сервис. Требует регистрацию, привязку и подтверждение к почте даже в торе и продаёт книжки за цену больше, чем они лежат в гугл-книгах.
Тем временем мурриканские реднеки добывают уран.
Хуй знает чем тебе Шульгин не угодил.
>2. Почему десятки различных в химическом смысле фенилэтиламинов и триптаминов оказываются психоактивными? Что именно их объединяет?
Они подходят к нужному рецептору.
>3. После ответа на предыдущий вопрос: если психоактивными их делает вот это вот объединяющее свойство, то почему эффекты оказываются существенно разными?
Одни больше подходят другие меньше, третьи цепляют ещё и другие рецепторы.
>4. Какие рецепторы на них реагируют? Почему?
Дофаминовые - на стимуляторы, серотониновые - на галлюциногены. Разные замещенные амфетамины и то и то обычно цепляют с разной силой. В смысле почему? Амфетамин похож на дофамин вот рецептор и реагирует и т.д.
>5. Ну и общий экскурс в историю и т.п.
Историю чего?
Phinkal и Thinkal как-то так. Я уебок и мог написать с ошибками.
1. ГЭБ проходит почти любая молекула без -OH группы и с молекулярной массой менее 500 дальтон.
2. Сродство к 5-HT-группам рецепторов, у тебя википедию заблокировали, что ли?
3. Потому что 5-HT-рецепторов куча кучная: от 1А до 2b. А этот ваш ЛСД вообще влияет на, примерно, 15 рецепторов.
4. см. 2 и 3, а также
>>28269
5. Всё началось с Большого Взрыва, а потом появились шаманские племена с совсем разными ПАВ от мухоморов до кактусов, в XX веке появилось ЛСД, МДМА и разные творения Шульгина, а в нашем, могучем XXI веке появилась рыгалка: мефедрон, JWH и карфентанил с бромдрэгонфлаем.
6. Любишь фарму — вступай в Pharm de Ground, легко гуглится.
Может быть у кого-нибудь есть ссылка или триал или чо-нибудь?
Если есть, кто шарит в расчетах по химии, буду рад поболтать в телеге или где-нибудь еще
Почему именно эта программа? Возьми что-нибудь более известное, типа orca и gaussian.
>>28278
Спасибо. Ладно, наверну Шульгина.
> ГЭБ проходит почти любая молекула без -OH группы
Согласно википедии, всё гораздо сложнее и я не смог сформулировать ясных правил, по которым бы это определялось. К тому же, у того же псилоцина есть -OH. Да и у самого серотонина. Впрочем, может вопрос наивный и таких внятных правил действительно просто нет.
> Pharm de Ground, легко гуглится
Не смог нагуглить. Не помогает и то, что я не знаю, что пытаюсь найти, конечно.
Уже нашел сам. Тред говно.
Пиши на roadintothevoid --- gmail.com
>1. У всех ли этих веществ есть какое-то общее свойство обусловленное "формой молекулы" или т.п., позволяющее веществам преодолевать гематоэнцефалический барьер или механизмы разные?
Да, липофильность. Часть ПАВ может пролезать через каналы или транспортные белки, но в целом для малых молекул важнее всего липофильность.
>1. ГЭБ проходит почти любая молекула без -OH группы и с молекулярной массой менее 500 дальтон.
Наличие гидроксильных групп не имеет особого значения.
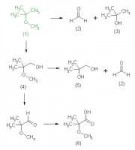
 25 Кб, 2102x824
25 Кб, 2102x824Нарисуй всё в пространстве. С KOH скорее всего будет aнти-E2 А диимид восстанавливает син.
Я сомневаюсь, что продукт Е2 будет основным. Там есть условия для SN1 - вторичный атом углерода, галоген и водная среда. Понятно, что можно нагреть смесь, но в схеме этого нет.
А рацемизация-то будет или нет? По идее, должна быть, т.к. диимид может подойти к плоскости двойной связи сверху или снизу, образуя R и S продукты, а хиральный центр из исходного соединения разрушается при образовании двойной связи.
Всегда, если исходное ахирально, то без другого источника наведения получается рацемат, можно не задумываться.
мимо
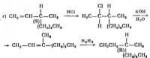
 20 Кб, 506x202
20 Кб, 506x202Вторичные реагируют обычно через контактные ионные пары. Поэтому скорее всего там E1 подобное E2
Где логика вообще?
Грязные реактивы.
>бензальдегид незамещенный сейчас в списке прекурсоров... Где логика вообще?
Если бы суды руководствовались логикой, то законы были бы не нужны. Законы сделаны имено потому, что в них нет логики - их просто требуется выполнять несмотря ни на что.
Бензальдегид можно получить из угля, водорода и кислорода.
>Бензальдегид можно получить из угля, водорода и кислорода.
Ты забыл про бульон выход продукта.
Он золотым нахуй получится, если из простых веществ синтезировать. Так-то и девятнадцатистадийный синтез морфина описан, но единственная ценность этого синтеза - служить примером в задачках на ретросинтетический анализ.
Ну, во-первых, налёт на медных и бронзовых изделиях - называется патина.
Если прогуглить это - можно прийти к следующей инфе на википедии:
Естественная патина — оксидно-карбонатная плёнка, образующаяся на поверхности декоративных (от памятников до монет) или технических изделий (разъёмы, контакты) под воздействием окружающей среды.
Оксид меди чёрный - карбонат меди (I), первая картинка, и карбонат меди (II) на второй картинке — зелёные,
также как и дегидроксикарбонат меди (II):
https://ru.wikipedia.org/wiki/Карбонат_меди(II)
Значит, в состав патины входит, как правило - карбонаты меди и дегидроксикарбонаты, и их надо получить.
Реакция коррозии меди вот:
2Cu + O2 = 2CuO; 2CuO + H2O + CO2 = (CuOH)2CO3
или вот - реакция получения дегидроксикарбоната меди во влажном воздухе 2Cu+CO2+O2+H2O -> CuOH2CO3↓
Но вместо того, чтобы получать патину из меди (которая достаточно стойка к коррозии),
проще получить её из оксида меди или сульфата, а потом - нанести.
Так обычно делают патинирование меди и сплавов на её основе (бронзы и латуни):
https://www.youtube.com/watch?v=MRVkRffHRBo
![tablicarjadjelektrootricatelnosti[1].jpg](/sci/big/thumb/424574/15159048768940s.jpg) 301 Кб, 1000x389
301 Кб, 1000x389Также глянь в сторону гальванических пар.
Вот что нашёл:
Титан как сильно электроотрицательный металл, является активным катодом в гальванической паре с железом, медью, алюминием, цинком.
Контакт с титаном ускоряет коррозию углеродистой стали, латуни, алюминиево-магниевых и медно-никелевых сплавов.
И раз здесь речь идёт о электроотрицательности - прилагаю таблицу электроотрицательности металлов. Пикрелейтед.
Съеби нахуй. Заебал. В каждом треде срет статьями с вики, и сука даже не скрывает, что сам нихуя не понимает.
>Съеби нахуй.
Покажи какой дорогой ты сам туда ходишь?
>Заебал.
Я тебя ещё голым не видел.
> В каждом треде срет статьями с вики
Ну я ж по теме.
>и сука даже не скрывает, что сам нихуя не понимает.
Лично я всё понял, а ты походу нихуя не понял.
Берёшь оксид, или сульфат меди, получаешь из них - зелёные карбонаты и дегидроксикарбонаты, патинируешь ими, всё.
А что касается гальванической пары так её суть в разнице между электроотрицательностями,
поэтому, наверное можно было бы быстрее подвергнуть медь коррозии
в гальванической паре её с каким-то более электроотрицательным металлом.
>В каждом треде срет статьями с вики
Это местный шизик. Он тут давно, его просто игнорят как юродливого.
Расскажи мне историю жизни своей. Ты наверное мечтал быть учителем, или поступить и двигать науку. Но не поступил. И теперь воннабихимик/физик в сци? Может попробуешь пересдать ЕГЭ и перепоступить?
Что значит ускорить? Ты их вовсе можешь закоротить, или поломать перегибанием.
Из домашней химии наиболее вероятно у тебя будет в наличии лимонная кислота с перекисью водорода. Следов мало, но раствор недолго живучий из-за распада перекиси. Второй раствор тоже можно намутить дома. Поваренная соль и медный купорос(использовали как антисептик и для протравы раньше в сельхознавозе). Естественно, сквозь изоляцию провода раствор на медные не подействует.
Одни наркоманы в сциентаче.
>>28936
>>28939
Хули вы тут какие-то сплетни развели обо мне - ещё и в третьем лице, блядь?
Есть конкретный вопрос анона >>28904 - и есть конкретный ответ.
Не нравится википедия - не ходи к ней.
А теперь пошли в уретру. Историю жизни им подавай, блядь...
Ну ок, смотрите, вот она прохладная...
Сначала родился, потом зашёл на двач, там прочитал вопрос и запостил ответ. Как-бы всё, но жизнь продолжается и ещё далеко не все...
А потом неизбежно произойдёт конвергенция сознания в безошибочность, как и полагается с детства.
И заебись...
Вот и вся история.
>>28904
>вместо того, чтобы получать патину из меди (которая достаточно стойка к коррозии),
>проще получить её из оксида меди или сульфата, а потом - нанести.
Кстати, ещё добавлю что карбонат можно получить из нитрата раствором соды:
2Cu(NO3)2+2Na2CO3+H2O -> CuCO3⋅Cu(OH)2↓ +4NaNO3+CO2↑
а нитрат меди - прямым действием азотной кислоты на медь:
https://www.youtube.com/watch?v=pqsskw5O77E
плавикова , азотная кислоты и щелок.
У плавиковой сложность с хранением, азотная высокой концентрации вроде тоже распадается через некоторое время. Ивообще является прикурсором. Что по поводу щелока? Тот который в кроте не концентрированный?
Механические способы и микроволновка не рассматриваются.
Потому что сахар "забивает" вкус кислоты. Меняется только вкус, но не кислотность среды.
>>28954
Мне кажется, что при нагреве до 600 там что-то плохое со схемой случится независимо от окисления.
Плавиковую кислоту легко можно сделать самому, но она не растворит кремний.
Есть твердый крот - это щелочь в гранулах. Готовь из него концентрированный раствор и кипяти в нем кристалл. Не забудь счистить с него корпус и прочее дерьмо.
Для травления кремния могут использоваться водные растворы щёлочей.
Травление кремния в щелочных растворах начинается при температуре раствора более 60 °C.
Si + 2KOH + H2O = K2SiO3 + 2H2 ↑
K2SiO3 + 2H2O ↔ H2SiO3 + 2KOH
Добра тебе, химик-семпай.
Нужен диэтиловый эфир, как я понимаю, он уже давно в списке прекурсоров и его обычному смертному не достать.
Как быть?
В каком Вы звании, товарищ ленивый хуй?
Пытаться из этанола и серной кислоты сварить. Реально, но требуется хорошая дистилляционная установка.
>>29287
https://www.youtube.com/watch?v=mw-2vipcmIQ
Важный момент: температура в колбе должна быть 140-145 градусов.
Если температура будет выше, то вместо эфира будет образовываться этилен.
Зависит от стекла. Обычное боросиликатное до 200-300 можно греть, главное не допускать локального перегрева. Пирекс заявлен до 500, но лично я бы зассал так его греть. Кварцевое - до 1000. Еще стоит помнить, что старая посуда может быть сделана из советского безаналогового стекла. У нас это говно пару раз взрывалось при попытке прогреть его промышленным феном, хотя нужная маркировка стояла.
>старая посуда может быть сделана из советского безаналогового стекла
ну хуй знает, у нас большинство старого стекла это чехи/венгры/гдр, в разы лучше нового
Потому что все советское (Made in USSR) выкинули/разбили, т.к. оно говенное и его не жалко.
Добавлю, у нас из советского оставались только пипетки, киппы (которые не использовали, ибо водород из баллона лучше), пробки, эксикаторы, колбы Бунзена (короче, все не термостойкое) и пара невъебенных колб на 4-6 литров, которые выкинуть жалко, а использовать негде.
С помощью изотопов определяют.
Принципиально - имеет, но вообще возможности простой перегонки сильно переоценены.
Продажный 96% просто сушат до абсолютного. Смысл в дистилляции азеотропного раствора? Для разделения смеси спиртов уже понадобится КОЛОН ОЧКА. Асло, если ты про алкогольные дистилляты, то в них много примесей.
Для дистлияции 95% спирта вроде надо минимум 6 дистиляций, для получения качественного спирта без ректификации хуй.
Абсолютный спирт вообще от воды негашеной известь очищают.
Ректификация - это, по сути, и есть многократная перегонка. Там дохуя циклов испарение-конденсация происходит. Простая дистилляция хорошо работает только при большой разнице Tкип.
А как же перегонка с паром? Обычно ее как некий аналог используют, или не всегда можно?
Только если соединение не растворяется в воде и не образует с ней азеотропную смесь.
А я и не про азеотроп говорил, а про то, что разница температур кипения с понижением давления увеличивается незначительно.
Как вы тут относитесь ко всяким Ванькам, что стремятся стать Уолтер Уайтами и лезут спрашивать про всякие запрещенные вещества?
Сразу скажу, что проводить синтез не намерен, мною ведет только интерес, не хочу иметь проблем с законом, употреблять такие вещества зарекся много лет назад, работать с опасными веществами не хочу, да и негде мне.
Недавно попалась статья про синтез из пластика, меня удивила простота и я решил получше разобраться в теме.
Хочу поделиться опытом, но понимаю, что информация может навредить Васькам и привлечь в тред лишнее внимание.
>Как вы тут относитесь ко всяким Ванькам, что стремятся стать Уолтер Уайтами и лезут спрашивать про всякие запрещенные вещества?
С юмором.
>Хочу поделиться опытом
А зачем если все уже есть?
Хорошо.
>>29536
Да. только использовать его - это чистое извращенство. А вот пиролиз упрощен, в найденных мною английских книгах советуют делать его под вакуумом в 10-20 мм. рт. ст и греть до температуры в 350-400, плюс только в том, что не надо ацетон отгонять. лучше уж водяная баня, костер обычный как раз даст 800 градусов.
>>29539
Да, информации очень много. найти легко. А мне понравилось заниматься изучением, только нужно что-то нормальное теперь найти и попробовать сделать.
Чтобы воду долго удерживали в целлюлозной губке при комнатной температуре и средней влажности жилых помещений, но не были коррозионными для железа, никеля, хрома. Желательно, но пока не обязательно, чтобы при нагреве до 360 градусов не разлагались на вредные для дыхания вещества.
>Подскажите, какие есть вещества с сильной гигроскопичностью?
Тут посмотри: https://ru.wikipedia.org/wiki/Гигроскопичность
Самым гигроскопичным веществом является оксид фосфора (V). P2O5.
Но он с водой образует фосфорную кислоту: P4O10 (2P2O5)+6H2O -> 4H3PO4 и она разъест эти твои металлы.
>Чтобы воду долго удерживали в целлюлозной губке при комнатной температуре и средней влажности жилых помещений
Ну, безводный хлорид кальция самое то. К тому же можно разложить потом гидрат.
Хлористый кальций — широко применяемый дешевый осушитель.
Он образует несколько гидратов с различной температурой разложения.
Его преимуществом является способность поглощать относительно большое количество воды,
а основным недостатком — слишком медленная сушка жидкости.
>Желательно, но пока не обязательно, чтобы при нагреве до 360 градусов не разлагались на вредные для дыхания вещества.
Ну, хлор из гидрата хлорида кальция даже если и получишь в незначительном количестве,
всё-равно останется гидроксид кальция, который с ним же и прореагирует.
На выходе может получится гипохлорит кальция: 2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O
или хлорка (хлорная известь) 2Cl2+2Ca(OH)2 -> Ca(Cl)OCl + CaCl2+2H2O
А эта, в свою очередь, при дальнейшем термическом разложении - вернёт хлорид кальция:
2Ca(Cl)OCl -> 2CaCl2 + O2↑ - с кислородом на выходе.
А гипохлорит этот, при нагревании - не всегда разлагается с выделением хлора:
Ca(ClO)2 -> CaCl2+O2;
Ca(ClO)2 -> Ca(ClO3)2+CaCl2;
Ca(ClO)2 -> CaO+Cl2; - но тоже может его выделять.
Если по последнему пути разложение идёт, то при повышении температуры до 700 градусов, может быть возвращён хлорид кальция.
Реакция оксида кальция с хлором. 2CaO + 2Cl2 → 2CaCl2 + O2. Условия: 700 °C.
>Подскажите, какие есть вещества с сильной гигроскопичностью?
Тут посмотри: https://ru.wikipedia.org/wiki/Гигроскопичность
Самым гигроскопичным веществом является оксид фосфора (V). P2O5.
Но он с водой образует фосфорную кислоту: P4O10 (2P2O5)+6H2O -> 4H3PO4 и она разъест эти твои металлы.
>Чтобы воду долго удерживали в целлюлозной губке при комнатной температуре и средней влажности жилых помещений
Ну, безводный хлорид кальция самое то. К тому же можно разложить потом гидрат.
Хлористый кальций — широко применяемый дешевый осушитель.
Он образует несколько гидратов с различной температурой разложения.
Его преимуществом является способность поглощать относительно большое количество воды,
а основным недостатком — слишком медленная сушка жидкости.
>Желательно, но пока не обязательно, чтобы при нагреве до 360 градусов не разлагались на вредные для дыхания вещества.
Ну, хлор из гидрата хлорида кальция даже если и получишь в незначительном количестве,
всё-равно останется гидроксид кальция, который с ним же и прореагирует.
На выходе может получится гипохлорит кальция: 2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O
или хлорка (хлорная известь) 2Cl2+2Ca(OH)2 -> Ca(Cl)OCl + CaCl2+2H2O
А эта, в свою очередь, при дальнейшем термическом разложении - вернёт хлорид кальция:
2Ca(Cl)OCl -> 2CaCl2 + O2↑ - с кислородом на выходе.
А гипохлорит этот, при нагревании - не всегда разлагается с выделением хлора:
Ca(ClO)2 -> CaCl2+O2;
Ca(ClO)2 -> Ca(ClO3)2+CaCl2;
Ca(ClO)2 -> CaO+Cl2; - но тоже может его выделять.
Если по последнему пути разложение идёт, то при повышении температуры до 700 градусов, может быть возвращён хлорид кальция.
Реакция оксида кальция с хлором. 2CaO + 2Cl2 → 2CaCl2 + O2. Условия: 700 °C.
Обычный силикагель
Безводный сульфат магния (лучше), или сульфат натрия (тоже сойдёт). Обезвоживание достигается нагреванием, весьма безопасны (оба с нехилым слабительным эффектом, но не ядовиты).
Годно для воды, но не гигроскопичны. Гигроскопичность подразумевает поглощение паров воды из воздуха.
Тут хлорид кальция и ещё гидроксид натрия сильно гигроскопичен, на воздухе «расплывается».
Но он хочет
>Чтобы воду долго удерживали в целлюлозной губке
Тогда, да. Если вода жидкая, то надо скорее гидрофильность, нежели гигроскопичность.
>сульфат натрия
Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O
10 молекул воды в кристаллогидрате на одну молекулу Na2SO4.
>сульфат магния
Образует несколько кристаллогидратов: MgSO4·nH2O, где n = 1, 2, 3, 4, 5, 6, 7, 12 - количество связываемых в кристаллогидрате молекул воды.
Наиболее изучены кристаллогидраты — MgSO4·7H2O (эпсомит), MgSO4·6H2O и MgSO4·H2O (кизерит).
Безводный сульфат магния получают сушкой кристаллогидрата:
(200 градусов цельсия) MgSO4⋅7H2O → MgSO4 +7H2O
А ещё, я видел Na2CO3·10H2O - тут аж 10 молекул воды в кристаллогидрате.
Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода.
>>29647-кун
12-ти водные кристаллогидраты:
Сульфат алюминия-аммония [AlNH4(SO4)2·12H2O, алюмоаммонийные квасцы]
Сульфат калия-алюминия [KAl(SO4)2·12H2O, алюмокалиевые квасцы]
Сульфат аммония-железа (III) [NH4Fe(SO4)2·12H2O, железоаммонийные квасцы]
Сульфат хрома(III)-калия [KCr(SO4)2·12H2O, хромокалиевые квасцы]
http://chemistry-chemists.com/N1_2014/ChemistryAndChemists_1_2014-P10-1.html
Кто больше молекул воды впихнёт в кристаллогидрат?
Алсо, тут какой-то пероксодикарбонат калия образует бесцветные гигроскопичные кристаллы тригональной сингонии.
но для его получения надо перекись расходовать, а при разложении - выделяется кислород.
http://wiki-org.ru/wiki/Пероксодикарбонат_калия
Можно ли повысить температуру разложения оксида? Конкретно: возможно ли существование оксида марганца при температуре 600-800°C?
Какой оксид? https://ru.wikipedia.org/wiki/Оксиды_марганца
При разложении диоксида марганца - тоже получается оксид.
Реакция термического разложения оксида марганца(IV): 4MnO2 -> 2Mn2O3 + O2; ΔG0 = 108 кДж/моль
Этот оксид уже разлагается при более высокой температуре, ну или при снижении давления:
(950-1100 цельсиев) Mn2O3 → 4Mn3O4+O2;
(300 − 600, vacuum) 6Mn2O3 → 4Mn3O4 + O2;
А этот Mn3O4 при 1160°С происходит переход в фазу кубической сингонии, а потом уже не разлагается, а плавится при 1560 °C; 1564 °C; 1705 °C.
Поясни. Если я какой-нибудь полисорб растворю с водой, то пропитанная им губка будет хорошо удерживать воду, не давая ей быстро испариться?
Спасибо всем отписавшимся, но вас немного понесло не туда. Вернее правильно по химии в кристаллогидраты, где вода связывается с солью, но не в запросе, где мне надо долго сохранить влажность целлюзной губки.
Я знаю про глицерин, но пока ищу другие способы, так как он при нагреве сильно дымит, а некоторые продукты разложения раздражают дыхательные пути.
Раскрою смысл. У радиомонтажников на подставке для паяльника имеются пару приспособлений для очистки жала от припоя, его окислов и нагаров от флюса. Одна из них влажная целлюлозная губка. Вода быстро испаряется, а пользоваться губкой надо влажной. Избыток воды также вреден для жала паяльника. Вот и решил поискать, хоть опытным путём, как дольше удержать влагу.
Попробуй просто гидроксид натрия.
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха.
Кипит он - при 1403 °C. Но с ним надо некоторые меры предостоожности: http://pripoi.ru/product_info.php?products_id=1081
Алсо, растворы NaOH + KOH в глицерине используют, как флюс для алюминиевой пайки.
Этот флюс там - вместе с ортофосфорной кислотой. Ортофосфорная кислота является неорганической.
Состав имеет химическую формулу H3PO4, представляет собой при стандартных условиях бесцветные гигроскопичные кристаллы.
Если нужна ещё большая гигроскопичность, можешь взять ещё оксид фосфора (V).
Он гигроскопичен и даёт ещё и ортофосфорную кислоту после поглощения паров воды.
Гидраты как флюсы тоже можно использовать, они называются гидратные флюсы.
Хранить порошкообразные флюсы ввиду их гигроскопичности рекомендуется в стеклянной посуде.
Ещё, гигроскопична молочная кислота (лактат) — α-оксипропионовая (2-гидроксипропановая) кислота СН3СН(ОН)СООН.
Из-за высокой гигроскопичности молочной кислоты обычно используют ее концентрированные водные растворы -
сиропообразные бесцветные жидкости без запаха.
Вот тут она вместе с флюсами: http://opiobjektid.tptlive.ee/Jootmine(vene)/___ro.html
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель.
Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства.
НАШАТЫРЬ - хлорид аммония (хлористый аммоний, техническое название — нашатырь)
NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Вот тут какой-то ОЧЕНЬ ГИГРОСКОПИЧНЫЙ флюс... Состав непонятен:
https://ua.all.biz/flyus-dlya-cinkovyh-splavov-zama-t1-g15528191
Кальция фторид представляет собой бесцветные кубические кристаллы или белый гигроскопичный порошок,
растворимый в растворах солей аммония, но мало растворим в кислотах.
Нитрат магния — неорганическое соединение, бесцветные гигроскопичные кристаллы.
Короче, ищи по ключевому слову "гигроскопичный флюс" и если найдёшь - отпишись тут, интересно какой из всех самый заебатый.
Попробуй просто гидроксид натрия.
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха.
Кипит он - при 1403 °C. Но с ним надо некоторые меры предостоожности: http://pripoi.ru/product_info.php?products_id=1081
Алсо, растворы NaOH + KOH в глицерине используют, как флюс для алюминиевой пайки.
Этот флюс там - вместе с ортофосфорной кислотой. Ортофосфорная кислота является неорганической.
Состав имеет химическую формулу H3PO4, представляет собой при стандартных условиях бесцветные гигроскопичные кристаллы.
Если нужна ещё большая гигроскопичность, можешь взять ещё оксид фосфора (V).
Он гигроскопичен и даёт ещё и ортофосфорную кислоту после поглощения паров воды.
Гидраты как флюсы тоже можно использовать, они называются гидратные флюсы.
Хранить порошкообразные флюсы ввиду их гигроскопичности рекомендуется в стеклянной посуде.
Ещё, гигроскопична молочная кислота (лактат) — α-оксипропионовая (2-гидроксипропановая) кислота СН3СН(ОН)СООН.
Из-за высокой гигроскопичности молочной кислоты обычно используют ее концентрированные водные растворы -
сиропообразные бесцветные жидкости без запаха.
Вот тут она вместе с флюсами: http://opiobjektid.tptlive.ee/Jootmine(vene)/___ro.html
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель.
Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства.
НАШАТЫРЬ - хлорид аммония (хлористый аммоний, техническое название — нашатырь)
NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Вот тут какой-то ОЧЕНЬ ГИГРОСКОПИЧНЫЙ флюс... Состав непонятен:
https://ua.all.biz/flyus-dlya-cinkovyh-splavov-zama-t1-g15528191
Кальция фторид представляет собой бесцветные кубические кристаллы или белый гигроскопичный порошок,
растворимый в растворах солей аммония, но мало растворим в кислотах.
Нитрат магния — неорганическое соединение, бесцветные гигроскопичные кристаллы.
Короче, ищи по ключевому слову "гигроскопичный флюс" и если найдёшь - отпишись тут, интересно какой из всех самый заебатый.
Ты какой-то наркоман
> Попробуй просто гидроксид натрия
Мне не нужен флюс. Остынь. Не копируй тупо информацию из поисковой выдачи.
Ну, тебе нужна была гигроскопичность - вот она, вот она, вот она...
> гидрогель
Это которым растения комнатные как бы поливают? Посмотрю вариант.
Из доступного и дешевого нашёл ещё диметилсульфоксид, но там тоже наркомания, при температуре кипения 189°C, температура разложения 150°C.
ДМСО, скорее всего, будет вонять при разложении.
Можешь попробовать раствор агар-агара с низкой концентрацией или поливинилового спирта в воде, только его надо растворять при нагреве. Агар агар в магазине для самодельной косметики или в магазине для выпечки можно купить, поливиниловый спирт уже скорее всего заказывать надо, но стоит он копейки. Теоретически его можно сшить к примеру бурой и получится желеподобная хрень, которая очень хорошо держит воду.
ЫХХЫХЫХЫХЫХХХХХ........
>MnO2
Если именно этот, то
>Реакция термического разложения оксида марганца(IV): 4MnO2 -> 2Mn2O3 + O2; ΔG0 = 108 кДж/моль
>Реакция протекает при температуре 530-585°C.
Если ты умудришься сделать давление кислорода 3000МПа то разложение только при 1000 начнется
Короче, задача такая: разлагать поток перекиси водорода. У неё только два неорганических катализатора: оксид марганца 4 и серебро палладий и некоторые другие, но это слишком экзотичные металлы. И я нашёл такую хуегру... Видео с демонстрацией разложения перекиси походу выпилили с ютуба. https://youtu.be/VesprTcNIdo Тут точно используется тот самый катализатор. Они его называют керамический катализатор. Что это такое? Я ничего не могу нагуглить про это. Я думаю, что это что-то хитровыебанное с оксидом марганца 4, потому что это самый такой мощный катализатор для перекиси
А зачем тебе температура 700 градусов?
Не хочу показаться занудой, но перекись при 500 и без катализатора разложена будет
У одного энтузиаста с реактивным ранцем для полётов было разобрано, как он его делал без доступа к конструкторской документации оригинала, зная только идею. Не помню, то ли бразилец, то ли из Южной Америки. Он установку для концентрирования перекиси ещё создал. Поищи.
Про керамику. Так есть готовые керамические катализаторы для газовых горелок или разлагающие остатки топлива до глушителя на американских авто. Там покрытие твоим палладием. Из него радиогубители хлорид палладия для технологии металлизации отверстий печатных плат получают. Ведь легально его приобрести геморрно.
Не стоит вскрывать тему использования перекиси в качестве топлива. У меня от этого Курск утонул.
>У курска не было реактивного двигателя на перекиси
А вот у его торпед - был, хоть и не реактивный. И именно перекись ебнула первой.
Протон-обменные топливные элементы, а есть какая-нибудь работа по ним? Знаю еще только про угольные.
Не так давно стала интересовать нейробиология. Из знаний – нихуя, за исключением пары лет работы с обработкой СТ/MRI снимков.
Хочу вкатиться с нуля, с чего начать? Могу в английский.
По биологии остановился на Campbell – Biology. Теперь нужна книжка по общей химии, чтобы понять предыдущую, посоветуйте чего-нибудь. Сильно вдрачивать химию я не хочу, достаточно на уровне происходящих в природе процессов, мет варить не буду.
Блин. Химия в этом плане довольна плоха. У неё порог вхождения высокий, даже для концептуального понимания.
Можно и просто графит еще.
Надо будет попробовать, интересно, насколько эффективно по сравнению с платиной.
В сети есть реклама дрона с графитовыми пластинами
http://en.mmcuav.com/ProductsSt/198.html
>достаточно на уровне происходящих в природе процессов
Ничесе у тебя замашки, проще уж мет сварить.
![6665001[1].jpg](/sci/big/thumb/424574/15177523925640s.jpg) 59 Кб, 497x454
59 Кб, 497x454Знаю, есть протонообменная мембрана, про топливные элементы такие не слышал.
Но на тебе вот это: https://best-energy.com.ua/support/battery/bu-210#battery-bu-210-010
ПОМТЭ (PEMFC — Protone Exchange Membrane Fuel Cell)
Вот по этой фразе и гугли.
>>30221
Чё это вдруг графен недоступен? Его даже в блендере делали и из соевого масла.
Поищи тут https://2ch.hk/sci/res/404479.html#404783 (
ещё поиском по странице пройди ключевое слово "графен", там много всякого.
Надо наверное воссоздать снова тред про материалы, и продолжить гуглёж и сбор новой инфы уже туда.
А вообще, осталю здесь алюминий-воздушные топливные элементы.
Там вроде-бы водород из алюминия с водой вырабатывается, как у этих: https://www.vesti.ru/doc.html?id=2919038
и сразу расходуется в топливном элементе. Пикрелейтед.
А вода потом - на алюминий идёт.
>Чё это вдруг графен недоступен? Его даже в блендере делали и из соевого масла.
Да в интернетах я видел, как делали лазером из полиимида, правда у них графен многослойный
http://news.rice.edu/2014/12/10/defects-are-perfect-in-laser-induced-graphene-2/
Там смешали жидкий полимиид с солями металлов (железо, кобальт или молибден)
Потом конденсировали его в пленку и обрабатывали лазером, потом обрабатывали лазером и нагревали в аргоне при 750 градусах в течении получаса.
По тесту получившийся материал показал способность к катализации.
Может это все просто громкие заголовки и в реальности оно намного хуже платины будет?
http://news.rice.edu/2015/08/20/laser-burned-graphene-gains-metallic-powers/
Еще знаю про смесь йода с графеном, но там вроде все сложнее немного.
Если все эти новые йоба материалы и правда могут заменить платину, то почему топливные элементы еще не продаются массово?
Это ведь самый эффективный источник энергии на сегодня.
>Там вроде-бы водород из алюминия с водой вырабатывается, как у этих
Погуглил, оказывается там сплав индия, галлия и олова, они удаляют оксидную пленку.
Но я бы не парился с этим и с щелочью реакцию провел.
>Поищи тут https://2ch.hk/sci/res/404479.html#404783 (
М)
ссылку пофиксил: https://2ch.hk/sci/arch/2018-01-09/res/404479.html#404783 (
>>30331
>Там смешали жидкий полимиид с солями металлов (железо, кобальт или молибден)
Важно понять, что вещество катализатора образует промежуточный продукт, который сразу же расспадается назад (те же соли металлов в графене).
И чтобы их ионы таки распались, а не соединились прочной ионной связью - надо графен.
Поэтому графен как связующее такое, пушистое, могло бы и удерживать наночастицы той же платины, снижая её расход.
Алсо, поддвачнув ещё раз этого >>30221 скажу что и палладий в той же группе, с никелем, а они дешевле.
>Может это все просто громкие заголовки и в реальности оно намного хуже платины будет?
В любом случае надо экспериментировать с катализаторами.
>>30333
Амальгамирование сделали, значит... Только вот сплав металлов, что ты написал - жидкий при обычных условиях.
А пластины у этих - твёрдые.
Сплавы галлия, индия и олова - имеют температуру плавления от 4,85 до 20 цельсия:
https://ru.wikipedia.org/wiki/Легкоплавкие_сплавы
Поэтому, скорее всего, там что-то типа этого: висмут 53,5 %, олово 19 %, свинец 17 %, ртуть 10,5 % (t° плавления 60°C)
Так как ртуть образует амальгаму с алюминием, но этот сплав не жидкий,
и при нагревании до 60 - уже может плавится, с дальнейшим амальгамированием.
>>30333
При большом выхлопе гидроксида алюминия, щелочь может поглощаться этим отходом,
ну или водой разбавляться с дальнейшим образованием оксидной плёнки,
а металл типа ртути и галлия - сплавляется с самим алюминием в амальгаме и прилипает к нему
(точнее проникает внутрь кристаллической решётки, образуя твёрдый раствор - интерметаллид).
>Поищи тут https://2ch.hk/sci/res/404479.html#404783 (
М)
ссылку пофиксил: https://2ch.hk/sci/arch/2018-01-09/res/404479.html#404783 (
>>30331
>Там смешали жидкий полимиид с солями металлов (железо, кобальт или молибден)
Важно понять, что вещество катализатора образует промежуточный продукт, который сразу же расспадается назад (те же соли металлов в графене).
И чтобы их ионы таки распались, а не соединились прочной ионной связью - надо графен.
Поэтому графен как связующее такое, пушистое, могло бы и удерживать наночастицы той же платины, снижая её расход.
Алсо, поддвачнув ещё раз этого >>30221 скажу что и палладий в той же группе, с никелем, а они дешевле.
>Может это все просто громкие заголовки и в реальности оно намного хуже платины будет?
В любом случае надо экспериментировать с катализаторами.
>>30333
Амальгамирование сделали, значит... Только вот сплав металлов, что ты написал - жидкий при обычных условиях.
А пластины у этих - твёрдые.
Сплавы галлия, индия и олова - имеют температуру плавления от 4,85 до 20 цельсия:
https://ru.wikipedia.org/wiki/Легкоплавкие_сплавы
Поэтому, скорее всего, там что-то типа этого: висмут 53,5 %, олово 19 %, свинец 17 %, ртуть 10,5 % (t° плавления 60°C)
Так как ртуть образует амальгаму с алюминием, но этот сплав не жидкий,
и при нагревании до 60 - уже может плавится, с дальнейшим амальгамированием.
>>30333
При большом выхлопе гидроксида алюминия, щелочь может поглощаться этим отходом,
ну или водой разбавляться с дальнейшим образованием оксидной плёнки,
а металл типа ртути и галлия - сплавляется с самим алюминием в амальгаме и прилипает к нему
(точнее проникает внутрь кристаллической решётки, образуя твёрдый раствор - интерметаллид).
Потому что реакция идёт в другую сторону: ZnCl2 + Ba(OH)2 = Zn(OH)2↓ + BaCl2
Хлорид бария - не подвергается гидролизу.
Ионная связь между хлором и барием в растворе сильнее, а гидроксид цинка - слабое основание.
Соль, образованная сильным основанием (в твоём случае это Ba(OH)2) и сильной кислотой (KBr, NaCl, NaNO3, BaCl2),
гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
Не подвергается гидролизу и гидроксид цинка - он у тебя вообще в осадке, какой может быть гидролиз?
И вообще, это основание, оно без гидролиза - с кислотой прореагировать может или с кислой солью какой-нибудь.
>Если все эти новые йоба материалы и правда могут заменить платину, то почему топливные элементы еще не продаются массово?
>Это ведь самый эффективный источник энергии на сегодня.
Потому что водород.
Как myo-inositol (который используется как БАД) взаимодействует с фитиновой кислотой в ЖКТ?
>ссылку пофиксил:
Я и сам справился, но спасибо.
>Важно понять, что вещество катализатора образует промежуточный продукт, который сразу же расспадается назад (те же соли металлов в графене).
А к чему тогда нагрев в аргоне?
>Поэтому графен как связующее такое, пушистое, могло бы и удерживать наночастицы той же платины, снижая её расход.
Было бы интереснее еще и сжать расстояние между атомами платины в таком случае.
Еще давно находил статью по этой теме:
https://www.gazeta.ru/science/2007/10/25_a_2263849.shtml?updated
Похоже, что платину придется где-то достать, как и тигель для нее, работать наверное очень сложно.
>В любом случае надо экспериментировать с катализаторами.
Вообще, сплав золота с медью должен представлять собой интерес, ну или палладия с кобальтом.
Еще бы узнать, насколько толстый слой должен быть у катализатора. Похоже, что все придется на практике познавать.
Фитиновая кислота - это фосфатированный инозитол. Не вижу причины, по которой они бы взаимодействовали.
>Протон-обменные топливные элементы
>>30284
>Знаю, есть протонообменная мембрана, про топливные элементы такие не слышал.
>>30284
>ПОМТЭ (PEMFC — Protone Exchange Membrane Fuel Cell)
>>30183
>заменить платину
>>30194
> Ищи катализаторы.
Как вариант - наночастицы карбида вольфрама в качестве катализатора : https://hightech.fm/2017/09/06/fuel-cell-tungsten
Но карбид вольфрама тугоплавкий материал - температура плавления 2780 °C.
Чтобы получить наночастицы первое что приходит в голову, так это быстро его испарить, а потом сконденсировать.
Но температура кипения жидкого карбида вольфрама (температура конденсации пара) составляет ещё больше: 6000 °C
Но сам вольфрам - довольно тугоплавкий, и плавится при 3422 °C, кипит же при 5555 °C.
Обычно процесс получения карбида вольфрама ведут при температуре 1300−1350 °C,
а это значит, что испарив вольфрам каким-нибудь лазером, можно нагнетать пары вольфрама в раскалённый ацетилен,
получая на выходе именно наночастицы карбида вольфрама.
Тащемта прогугли по этим пикчам в гугл картинках, найдёшь методы получения нанодисперсного порошка.
P.S.: Присмотрелся туда внимательнее - и вижу что вообще-то у них там есть некая технология производства с увеличением площади, но она не расписана там.
Алсо, я тут по пути ещё нашёл какой-то неведомый катализатор: http://tass.ru/nauka/4812202
но пофиг что это за вещество, главное то, что он очищает водород от угарного газа CO.
И думается мне, что если карбид вольфрама не реагирует с CO, топливный элемент на его основе будет ещё долговечнее вперемешку с этим ебучим CO.
Ведь в этой статье написано следующее: Получающийся в ходе реакции угарный газ повреждает топливный элемент.
>А к чему тогда нагрев в аргоне?
Ну, если пиролизом полиимида они получали там многослойный графен,
то наверное для того - чтобы углерод не окислился до CO или CO2...
Хотя я вижу в структурных формулах полиимида некое количество кислорода,
но помимо него, там есть ещё и водород в бензольных кольцах.
Он может с кислородом - в воду уходить при пиролизе, не окисляя углерод графена.
>Алсо, я тут по пути ещё нашёл какой-то неведомый катализатор: http://tass.ru/nauka/4812202
Я так и не понял, откуда берется СО. Топливный элемент деградирует с образованием СО или что?
>то наверное для того - чтобы углерод не окислился до CO или CO2...
Но до этого никакого нагрева не использовали, в статье про получение графена нет никакого упоминания нагрева.
Там написано же, жёппой читаешь.
Есть специальные увеличители пробега, или range-extenders: они работают на традиционном топливе (где получается CO)
и увеличивают дальность пробега, подзаряжая батарею.
>>30444
Сам же написал:
>нагревали в аргоне при 750 градусах в течении получаса
Химическая активность разных форм углерода убывает в ряду:
аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно
выше 300—501 °C, 600—700 °C и 800—1000 °C.
Зачем нагревали в аргоне - так и не понял, но поскольку ты написал ещё это:
>смешали жидкий полимиид с солями металлов (железо, кобальт или молибден)
то могу предположить, что нагревали для проникновения расплава солей внутрь слоёв графена.
Потому что процесс кристаллизации этих солей из водного их раствора - чревато образованием например какого-нибудь
оксида графена с -OH групами: https://ru.wikipedia.org/wiki/Оксид_графита
Ну и не очень равномерно вырастут кристаллы эти, внутрь слоёв не зайдут (образуя бутерброд, как на пикрелейтед),
а при реакции окисления водорода - могут быть ещё и вымыты образующейся водой, если эти соли растворимы в ней.
К тому же трехмерный графен в MIT получили именно сжатием и СПЛАВЛЕНИЕМ хлопьев графена (пик2):
https://www.popmech.ru/science/312982-mit-sozdal-novyy-sverkhlegkiy-i-sverkhprochnyy-material/
Так что возможно сплавление графена и позволяет удерживать этот солевой катализатор, без его вымывания.
>Там написано же, жёппой читаешь.
>Есть специальные увеличители пробега, или range-extenders: они работают на традиционном топливе (где получается CO)
и увеличивают дальность пробега, подзаряжая батарею.
Нет, там написано, что СЕЙЧАС эти увеличители работают на ископаемом топливе, а они хотят их заменить на топливные элементы, работающие на водороде.
>Еще знаю про смесь йода с графеном
А каким образом можно заставить их соединиться? Реакция электрофильного замещения?
>СЕЙЧАС эти увеличители работают на ископаемом топливе
Ну, я в глаза не ебался вчера , а вроде только позавчера.
>Я так и не понял, откуда берется СО. Топливный элемент деградирует с образованием СО или что?
ИМХО, там - предлагают юзать либо прямой метаноловый топливный элемент,
или просто метанольный топливный элемент для производства водорода,
с последующей подачей его уже в водородный топливный элемент.
А при разложении метанола, наряду с реакцией: CO2 + 3H2. ⇄ CH3OH + H2O
ещё идёт реакция H2O + CO ⇄ H2 + CO2
Ну и возможно окисление его до формальдегида CH3OH + O2 = CH2O + H2O
с последующим его горением: CH2O + O2 = CO + H2O
Поэтому от угарного газа - полученный водород и очищают там этим катализатором.
Ответы на все твои вопросы - https://www.maps.org/research-archive/w3pb/2004/2004_Nichols_22684_1.pdf весьма годный обзор + огромный список литературы, если какой-то вопрос интересен более подробно. Эти вещества - агонисты 5HT2A-рецепторов (серотонин), именно это их и объединяет.
http://pubs.rsc.org/en/content/articlelanding/2014/lc/c4lc00029c#!divAbstract
От температуры зависит выход угарного газа при разложении муравьиной кислоты.
Серная кислота - выступает в качестве водоотнимающего средства.
Упаривая воду из раствора серной кислоты можно поддерживать её концентрацию, и этот процесс тоже зависит от температуры.
http://files.school-collection.edu.ru/dlrstore/665a25f3-5872-5a4a-073f-e824d8b2c563/index.htm
>В пробирку с муравьиной кислотой прибавим концентрированную серную кислоту. Сразу же начинается бурная реакция.
Это если на угарном газе ездить, нужна серная кислота.
Но... Муравьиную кислоту можно разлагать и по-другому, пик2.
При этом выделяется водород, идущий на топливный элемент с протонообменной мембраной.
Вот тут катализаторы и зависимость от температуры: https://studopedia.info/7-25472.html и как доступный вариант - палладий.
Здесь ещё нашёл комплексный катализатор на основе карбонила железа: http://муравьиная.рф/novyj-katalizator-polucheniya-vodoroda-iz-muravinoj-kisloty
Алсо, вот: https://futurist.ru/news/1236
>катализатором выступило химическое соединение из серебра, соли и комбинации лигандов
>молекулярный катализатор, который заставляет муравьиную кислоту производить только водород и углекислый газ (без побочных продуктов) при температуре всего 70°С.
Структурная формула и состав катализатора - в статье здесь: https://phys.org/news/2016-06-molecular-hydrogen-powered-cars-motoring.html
Почему палладий только? Там медь вполне неплохую результативность показывает, можно попробовать с серебром смешать.
Но мне удалось найти некоторую зависимость, мощность и правда будет увеличиваться с температурой.
http://onlinelibrary.wiley.com/doi/10.1002/fuce.200400052/epdf
Палладий в этом случае даже эффективнее платины, температура в 70 градусов самая эффективная. Надо бы медь попробовать.
 319 Кб, 1052x1402
319 Кб, 1052x1402Как можно получить серную кислоту с концентрацией 308 г/л, на 24,7 Л объёма?
Просто из лаборатории пришли анализы по содержанию кислоты и купороса в растворе меднения, одного больше чем по норме, другого меньше, все единицы указаны в г/л, вот и как мудак час не мог решить задачку чего сколько слить и сколько долить.
>30.8%
По массе или по объему? Плотность её смотри.
P.S.:
Обычно процентное соотношение указывается по массе.
Плотность концентрированной серной кислоты ρ = 1,84 [г/см3]
и 308 г её занимает объем: V = m/ρ = 308 [г] / 1,84 [г/см3] = 167,39 см3
это объем концентрированной серной кислоты массой 308 грамм. Всё остальное - вода.
Не забывай лить кислоту в воду, а то она нагревается так, что вода кикит и кислота может расплескаться.
Да, забыл ещё вот что - у тебя там литры, а я считал сантиметры кубические.
1 л = 1000 см3.
Т. е. если по массе процентное содержание 30.8%, то по объему:
167,39 см3 кислоты / (1000 см3 - 167,39 см3) воды =
167,39 см3 кислоты / 832,61 см3 воды = примерно 0,201 вот такая часть объема кислоты в воде.
Дальше, 0,201 × 100% = 20,10% (уже меньше чем 30.8%).
Иначе, если 30.8% это процент по объему у тебя, то всё наоборот, и по массе уже будет больше процент чем по объему.
Как считать?..
1000 см3 раствора /100% × 30.8% концентрация кислоты по объему = 308 см3 объем кислоты получается в литре раствора.
масса кислоты через её плотность и объем при этом равна m= ρ × V = 1,84 [г/см3] × 308 см3 = 566,72 г.
т. е. 566,72 г/л, и так как литр воды весит 1000 г, то процент по массе (566,72 [г] / 1000 [г]) × 100% = 56,672%
Нет. В процентах чаще всего пишут массовую долю (г кислоты на 100 г раствора). г/л - массовая концентрация (вроде она так в русском называется), г кислоты на литр раствора. Из кислоты какой концентрации будешь готовить раствор?
>>30612
>1000 см3 раствора /100% × 30.8% концентрация кислоты по объему = 308 см3 объем кислоты получается в литре раствора.
>масса кислоты через её плотность и объем при этом равна m= ρ × V = 1,84 [г/см3] × 308 см3 = 566,72 г.
А почему ты решил, что объемы кислоты и воды при смешивании складываются напрямую?
>А почему ты решил, что объемы кислоты и воды при смешивании складываются напрямую?
Из допущения, что концентрация в процентах может быть не по массе, а по объему.
Т. е. процентная концентрация по объему. Просто отношение объемов, выраженное в процентах.
Но там они вместе и в перемешку - Весообъёмные (массо-объёмные) проценты называются.
А так-то да, плотность при смешивании - меняется, и осуществляется проникновение растворов -> объем меняется.
>Есть ли кофеин / теин в элеутерококке?
Вроде-бы нет, но нашёл что-то усиливающее эффект кофеина.
Нашёл вот здесь вот: https://impotencija.net/narodnye-sredstva/kak-prinimat-eleuterokokk/
Цитата: Экстракт элеутерококка усиливает действие принимаемых стимуляторов и аналептиков (таких как кофеин и др.).
Также, нашёл элеутерококк - вот здесь: https://mansecret.net/rastitelnyy-yekstrakt-yokhimbe-sosta/
вместе с молекулой Йохимбина. Может это она усиливает действие кофеина??
Но нет, чуток погуглив - нашёл другое название элеутерококка - сибирский женьшень.
Сначала подумал вкинуть тебе это, ну потому что женьшень: https://ru.wikipedia.org/wiki/Женьшень#.D0.94.D0.B5.D0.B9.D1.81.D1.82.D0.B2.D1.83.D1.8E.D1.89.D0.B8.D0.B5_.D0.B2.D0.B5.D1.89.D0.B5.D1.81.D1.82.D0.B2.D0.B0_.D0.BA.D0.BE.D1.80.D0.BD.D1.8F
но затем просто допёр своей башкой - ввести в гугл вот такой поисковый запрос: "Действующие вещества корня элеутерококка"...
Нашёл это: https://herbal-grass.com/medicinal-plants/eleutherococcus-senticosus.html
(только там не копируется нифига, приходится с исходного кода вырывать).
Цитата:
> <p><b>Действующие вещества:</b> в корнях и корневищах элеутерококка колючего
> обнаружено 7 гликозидов,названных элеутерозидами А, В, С, D, E, F.
> В кристаллическом виде выделено 5 элеутерозидов, относящихся к лигнановым гликозидам.
> Кроме того, корни содержат пектиновые вещества, смолы, камеди, антоцианы и 0,8 % эфирного масла.</p>
Если не указано, что доля объемная, подразумевается массовая.
Спасибо, бро!
 91 Кб, 240x240
91 Кб, 240x240>>30647
Я вообще нашёл какую-то таблицу и там 308 г/л соответствовала 26% серная кислота.
Пока даже не знаю какая есть на предприятии, 20% скорее всего.
В анализах ничего не уточнялось про единицы измерения, по объёму или по массе, просто написали г/л. Я отдавал им 200 мл раствора на анализ, а там хз, в оборудовании они это замеряли или титровали как, не известно.
Из 20%-ой 26%-ую ты не сделаешь.
Если указаны г/л, то это всегда "сколько граммов кислоты содержится в литре раствора".
А что из вводного курса органики за эти годы поменялось (кроме физметодов, биохимии и нанохуйни)?
Это ты зря, книга до сих пор не потеряла своей актуальности, в качестве введения в адекватную современную органику просто 10/10. А после неё можно сразу Advanced Organic Chemistry Кэри и Сандерса читать, какое-нибудь из последних изданий, и будет заебок.
Чем можно удалить/уменьшить въевшуюся на поверхности ржавчину в мраморе без его разрушения?
Кальцит — CaCO3, доломит — CaMg(CO3)2
Оксид железа III — Fe2O3·nH2O, метагидроксид железа (FeO(OH), Fe(OH)3)
Напрямую кислотами нельзя, разъест мрамор.
Существуют специальные средства.
Я бы ебнул кальция цианида. Но где ты цианид кальция возьмешь) Он ядовитый.
>где ты цианид кальция возьмешь
Из карбида: CaC2 + N2 → Ca(CN)2 + C(графит) (Условия: 1000 — 1150 °C)
Малораспространенный цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C.
Только нахрена этот цианид кальция нужен там?
Ты рассчитываешь получить реакцией замещения гидроксид кальция и цианид железа что-ли?
Так цианид железа (II) нерастворим и выпадает в осадок, как и ржавчина.
>>31161
Посмотри специальные моющие составы по запросу в гугле "ржавчина из мрамора"
Ты неправильно загуглил. Цианамид и цианид разные вещи)
Цианид анион это CN- изоэлектронный CO
Цианамид анион это NCN2- Изоэлектронный СО2
В смысле зачем? Железо образует комплекс [Fe(CN)6]3-
Цианид кальция обменяет железо на кальций.
![126659746100832088.pdf-28[1].jpg](/sci/big/thumb/424574/15188393885780s.jpg) 23 Кб, 720x540
23 Кб, 720x540>Цианид анион это CN- изоэлектронный CO
>Цианамид анион эт
Про ионы - понятно. Пикрелейтед.
>Ты неправильно загуглил. Цианамид и цианид разные вещи)
Да, внатуре, там был цианамид кальция CaCN2: https://chemiday.com/reaction/3-1-0-1770
Это я уже скобки добавил. Просто вижу в википедии https://ru.wikipedia.org/wiki/Цианид_кальция
следующую строку:
>Малораспространенный цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C.
и сложилось впечатление, что цианамид распадается-таки в цианид, потому то статья про цианид кальция.
Но я также вижу и следующую реакцию здесь: https://ru.wikipedia.org/wiki/Цианиды#.D0.9F.D0.BE.D0.BB.D1.83.D1.87.D0.B5.D0.BD.D0.B8.D0.B5
Другой промышленный метод получения цианида натрия — сплавление цианамида кальция с углем
и хлоридом натрия либо содой с образованием цианплава:
CaCN2 + C + 2NaCl → 2NaCN + CaCl2
Т. е. цианамид кальция даёт цианид натрия реакцией замещения здесь.
Что если вместо хлорида натрия (температура плавления 800,8 °C)
использовать хлорид кальция (температура плавления 772 °C)?
Даст ли цианамид - цианид кальция?
Я также вижу, что для получения цианида из цианамида - может быть использована сода
(это карбонат натрия или гидрокарбонат, распадающийся при нагревании в этот карбонат).
Так вот, температура плавления карбоната натрия 852 °C,
в то время как температура плавления карбоната кальция не так уж далека 825 °C,
к тому же сам карбонат кальция тоже содержится в кальците мрамора.
>В смысле зачем? Железо образует комплекс [Fe(CN)6]3-
Комплекс комплексом, вопрос в том, растворима ли будет комплексная соль.
И если ты про гексацианоферрат(II) кальция, то да он растворим в воде.
>Цианид кальция обменяет железо на кальций.
Вот тут-то я и думал после реакции замещения получится цианид железа (II), а он не растворим в воде.
Но ты говоришь, получится комплексная соль. Можешь написать реакцию?
Я вижу только реакцию с солями, например сульфат железа: FeSO4 + 3Ca(CN)2 → Ca2[Fe(CN)6] + CaSO4
![126659746100832088.pdf-28[1].jpg](/sci/big/thumb/424574/15188393885780s.jpg) 23 Кб, 720x540
23 Кб, 720x540>Цианид анион это CN- изоэлектронный CO
>Цианамид анион эт
Про ионы - понятно. Пикрелейтед.
>Ты неправильно загуглил. Цианамид и цианид разные вещи)
Да, внатуре, там был цианамид кальция CaCN2: https://chemiday.com/reaction/3-1-0-1770
Это я уже скобки добавил. Просто вижу в википедии https://ru.wikipedia.org/wiki/Цианид_кальция
следующую строку:
>Малораспространенный цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C.
и сложилось впечатление, что цианамид распадается-таки в цианид, потому то статья про цианид кальция.
Но я также вижу и следующую реакцию здесь: https://ru.wikipedia.org/wiki/Цианиды#.D0.9F.D0.BE.D0.BB.D1.83.D1.87.D0.B5.D0.BD.D0.B8.D0.B5
Другой промышленный метод получения цианида натрия — сплавление цианамида кальция с углем
и хлоридом натрия либо содой с образованием цианплава:
CaCN2 + C + 2NaCl → 2NaCN + CaCl2
Т. е. цианамид кальция даёт цианид натрия реакцией замещения здесь.
Что если вместо хлорида натрия (температура плавления 800,8 °C)
использовать хлорид кальция (температура плавления 772 °C)?
Даст ли цианамид - цианид кальция?
Я также вижу, что для получения цианида из цианамида - может быть использована сода
(это карбонат натрия или гидрокарбонат, распадающийся при нагревании в этот карбонат).
Так вот, температура плавления карбоната натрия 852 °C,
в то время как температура плавления карбоната кальция не так уж далека 825 °C,
к тому же сам карбонат кальция тоже содержится в кальците мрамора.
>В смысле зачем? Железо образует комплекс [Fe(CN)6]3-
Комплекс комплексом, вопрос в том, растворима ли будет комплексная соль.
И если ты про гексацианоферрат(II) кальция, то да он растворим в воде.
>Цианид кальция обменяет железо на кальций.
Вот тут-то я и думал после реакции замещения получится цианид железа (II), а он не растворим в воде.
Но ты говоришь, получится комплексная соль. Можешь написать реакцию?
Я вижу только реакцию с солями, например сульфат железа: FeSO4 + 3Ca(CN)2 → Ca2[Fe(CN)6] + CaSO4
>>31544
>Я вижу только реакцию с солями, например сульфат железа
Ну да, такая же реакция. Только замени анион карбонат. Или гидроксид.
Просто почему остаются такие оранжевые разводы. Железо "въедается" в мрамор, и замещает часть ионов кальция в нём. Если подумать, то все средства довольно кислые, и тонкий слой мрамора точно снимают сверху. Возможно единственный способ.
>Ну да, такая же реакция. Только замени анион карбонат. Или гидроксид.
Fe(OH)2 + 3Ca(CN)2 → Ca2[Fe(CN)6] + Ca(OH)2.
FeCO3 + 3Ca(CN)2 → Ca2[Fe(CN)6] + CaCO3
Всё правильно?
Если да, то с первой реакцией - всё понятно, гексацианоферрат кальция просто растворяется.
Гидроксид кальция - хоть и плохо растворяется, но счищается.
Но вот вторая реакция - вызывает вопрос.
Как ржавчина по-твоему должна превратится в карбонат?
Вот так? Fe(OH)3 + CaCO3 = Ca(OH)2 + Fe2(CO3)3
Нагревать надо?
Ну и если карбонат железа можно получить за счёт карбоната кальция в самом кальците мрамора,
то его же можно по-другому как-то убрать: https://ru.wikipedia.org/wiki/Карбонат_железа(II)
Растворяется в растворах бикарбонатов или при пропускании углекислого газа через суспензию:
FeCO3 + 2NaHCO3 → Fe(HCO3)2 + Na2CO3
FeCO3 + CO2 + H2O → Fe(HCO3)2
Полный синтез каждого ингридиента можно сделать, но для этого надо целая лаборатория и дохрена многостадийных реакций.
Поэтому дорогое бухло на то и дорогое, что синтез осуществляется микробиологический без всяких прибамбасов, а ценится в основном выдержка.
Сам по себе этанол можно и гидратацией этилена получить и даже растворить что-то в нём,
но французских коньяк 1865 года гидратацией этилена ты не получишь, результат радиоуглеродной датировки будет совсем не тот.
 128 Кб, 799x1024
128 Кб, 799x1024На торрентах много литературы по химии.
Советуем космохимию
У нас так "абсент" делали. Насыпали в колбу ТРАВ, наливали спирта и кипятили.
Интересно, что произойдет раньше: допилят искусственные нейросети или найдут способ запихнуть крысиный мозг в банку и заставить его считать белки?
Может скорее белки заставят при свёртке в третичную структуру и развёртки из неё - производить вычисления?
Вот тут какой-то метод разворачивания белков: http://www.chemport.ru/datenews.php?news=500
Ну и спираль ДНК тоже расплетается, в ДНК можно хранить информацию. Как-то пхнули 700 терабайт в 1 грамм.
К тому же не так давно, расшифровали приватный ключ биткоина, зашифрованный в ДНК.
Т. е. хранить информацию можно в молекулах, но что если её ещё и изменять там, как в памяти оперативной?
Эдакий белковый процессор + protein_RAM и фермы fermentative_GPU_mining_farm 500 петахешей в секунду, лол.
Я вообще не понимаю, в чём профит дорогого бухла перед дешёвым. Бизнес, понты.
Алмаз можно заменить хрусталём в брюликах, золото латунью.
От того же коньяка или виски прибыль ты получишь только через 5 лет после его дистилляции. Вот и цены высокие. Это водовку можно из опилок гнать и БОЯРАМ в тот же день продавать у ворот завода.
Я бизнес-план под проивзодство дистиллятов в ЕС составлял, там нихуя не СВЕРХДОХОДЫ получаются при текущих рыночных ценах.
>>32347
Периферия проще и мусорного ПО установлено меньше.
Ты водку нормальную видел? Она стоит пиздец сколько. В СШП проще было набухаться текилой хорошей, чем покупать абсолют за 3-4к рублей бутылка. И это по старому курсу.
>набухаться
>текилой
Ну хуй его знает. Недавно выжрали вдвоем 0,7 - ни в одном глазу. Текила была с родины.
Ну так водка и не дистиллят.
И кстати, я нашел там реакции, с помощью которых можно синтезировать электролит, кучу научных статей перерыл, но вроде понял, как синтезировать GCD, а насчет ESB(erbia-stabilized bismuth oxide) я пока ничего не успел найти.
Как бы провести синтез и остаться целым?
Ну да,90% перекись нихуево так ебошит.Даже на свету,поскольку в дело вступает фотохимия.Другое дело,что перекись очень чувствительна ко всякого рода примесям - даже частицы пыли способны вызвать каталитическое разложение.
Погугли оганова на ютубе,он занимается квантово-механическими расчетами молекул.мб контакты его найдешь.
вот еврей
Леха,ты ли это?Тебя мамка выселила?
Можно,брат.Проверял лично.Грей хоть аптечную перекись при 80-90 градусах.(если время позволяет,то при 60,но это надолго).Таким образом выйдет перекись, 20-35%.
Я имел ввиду, в чём профит покупать дорогое бухло.
>Периферия проще и мусорного ПО установлено меньше.
Блин, интересно. Есть чё почитать на эту тему?
>Можно,брат.Проверял лично.
Ну хорошо, надеюсь она не ебнет мне в лицо или не загорится.
Кстати, получается, что при ее разложении выделяется кислород, а происходящая реакция нагреет его.
Если этот кислород смешать с метаном и поджечь, то температура горения сильно повысится?
Для метана это не так критично, он и обычным воздухом хорошо окисляется. Алсо, смешивать горючий газ с кислородом - очень плохая идея. Погугли, как устроены кислородные горелки и как там происходит смешивание газов
фейкомыльце: leshi9&a_gornyyANUSmailn}DPUNCTUMr5Ypu
У него вообще есть практическое применение?
 37 Кб, 800x800
37 Кб, 800x800там эта, попсхимик сдаётся, голодает на 3500 рублей, истерит, клянчит и грозит закрыться. чоделать?
https://www.youtube.com/channel/UCRzZSz5JlSfN6Ba164vqVCg/community?lb=UgzmfkliMq4OrRIYkt14AaABCQ
Образование большого количества азота N2 обусловлено окислением аммиачно-водородной атмосферы
молекулярным кислородом O2, который стал поступать с поверхности планеты в результате фотосинтеза, начиная с 3 млрд лет назад.
Также азот N2 выделяется в атмосферу в результате денитрификации нитратов и других азотосодержащих соединений.
Окислять его с малыми энергозатратами и переводить в биологически активную форму могут цианобактерии (сине-зелёные водоросли)
и клубеньковые бактерии, формирующие ризобиальный симбиоз с бобовыми растениями,
которые могут быть эффективными сидератами — растениями, которые не истощают, а обогащают почву естественными удобрениями.
Пускай либо хайпит либо закрывается год назад у него такая же ситуация вроде была тогда ему задонили. Поэтому он должен был уже понять, что на днотубе востребован научпоп по типу TrashSmas и Drugslab. Ну или остаётся на таком же уровне на котором он сейчас.
>Ну или остаётся на таком же уровне на котором он сейчас
Согласен, уровень низок. Ему бы расти. А то школьная химия это просто смешно.
а то я не знал
 73 Кб, 476x861
73 Кб, 476x861А если раскурочить сканы практических руководств?
Вопрос теоретический.
 7 Кб, 332x687
7 Кб, 332x687Темплейты в ChemSketch, например.
Там целая технология, с колоннами, конденсаторами, охлаждением и прочее.
Чё б не попробовать - через сульфат меди? Смотри:
H2S + CuSO4 = CuS↓ + H2SO4; на входе - сероводород
2CuS + H2 → Cu2S + H2S↑; здесь он выделяется
Cu2S + 2O2 → 2CuO + SO2↑ - сульфид меди в кислороде.
CuO + SO2 → CuSO3 - оксид меди окисляется в сульфит
4CuSO3 = CuS + 3CuSO4 - разложение сульфита, и возврат сульфата с моносульфидом меди.
При горении окислении сульфида меди кислородом, возможна реакция разложения:
Cu2S → CuS + Cu; термическое разложение. Здесь - восстанавливается медь.
4Cu + SO2 → Cu2S + 2CuO; медь здесь окисляется газом SO2
Также, возможна реакция разложения моносульфида меди:
2CuS → Cu2S + S - разложение без доступа кислорода.
Я просто проходил мимо, но увидев твоё творение не могу не сказать ты ёбаный извращенец без личной жизни.
Всё это прикольно, но слишком бумажно и на практике тебе пукнут в нос твоим сереводородом.
Самое простое что можно сделать -- аккуратно выпаривать на масляной бане электролит для акб. Хотя здесь и не получишь концентрат, но для законного использования и хранения больше и не понадобится.
Электролит любой дурак может упарить, а ты попробуй серу или SO2 - до SO3 окисли.
В башенном методе используется реакция: SO2+NO2 + H2O -> H2SO4+NO↑ (SO3 + H2O + NO↑); SO3 + H2O -> H2SO4;
Т. е. там SO2 переходит в SO3.
Можно его прямо в кислороде палить, на катализаторах, под нагревом и давлением:
2SO2+O2 -> 2SO3; (kat. V2O5, 450°C, P=20MPa~197 атмосфер).
А можно было бы, как написал я - юзать кислород из оксида меди, с разложением сульфита до сульфата.
И если тебе из серы или сернисого газа надо получить серку, то серу можно спалить в водороде - и получить H2S,
а SO2 - на оксид меди можно подать, с образованием сульфита.
Можно ещё через бром окислить сернистый газ: SO2 + Br2 + 2H2O -> H2SO4+2HBr;
с пропусканием кислорода через раствор: 4HBr + O2 -> 2Br2 + 2H2O; и отгонкой газообразного брома (кипит при 58,6 °C).
Но там газы, и наверняка дело пошло бы стехиометрически, под некоторым давлением.
Серную кислоту потом с водой упарить при температуры близкой к кипению воды, и бром улетучится, вместе с HBr.
 42x5
42x5Бром, ещё и с серой реагирует, если нагреть - тоже получается серная кислота:
(100-150°C) 3Br2 + S + 4H2O -> H2SO4+6HBr; Здесь никакого SO2, но температура кипения воды и выше.
Сконденсированные пары серной кислоты могут давать разбавленную или концентрированную H2SO4 (кипит она при 337 °C).
Аноны,помогите пожалуйста или скажите где с этим вопросом мне смогут помочь.
Дело в том,что мне нужно рассчитать дозировку препарата тирозол что бы снизить гормон т4.
И того дано:
Норма свободного т4:12-20 пмоль/л
У меня он - 15,25
А тирозол продается в таблетках по 5 и 10 мг.Пьют его 1 раз в день. По сколько мне его принимать,чтобы снизить т4 до 10-11 пмоль/л.
Помогите плиз.
А на схеме разве не контактный метод?
>>34060
А можно SO2 озоном окислить? Просто в моем случае чем меньше ингредиентов- тем лучше, а чтобы получить озон нужна только катушка румкорфа, озонатор, источник питания на 12 вольт (12 последовательно соединенных картофелин) и что-то чтобы гнать воздух.
И да, SO2 это что, газ?
Я же говорю, вопрос чисто теоретический. Если бы мне понадобилась концентрированная соляная кислота на практике, я бы выпарил её из электролита, концентрацию можно довести до 98 с чем-то процентов.
И да, безопасность при работе с хим реакциями определяется не знанием химии, а знанием ТБ.
 512x468
512x468>И да, безопасность при работе с хим реакциями определяется не знанием химии, а знанием ТБ.
Я даже комментировать ничего не буду.
>Если бы мне понадобилась концентрированная соляная кислота на практике, я бы выпарил её из электролита, концентрацию можно довести до 98 с чем-то процентов.
ОРУБЛЯДЬ
>И да, безопасность при работе с хим реакциями определяется не знанием химии, а знанием ТБ.
Типикал биоробот.
 7 Кб, 186x200
7 Кб, 186x200>довёл бы выпариванием соляную кислоту до 98%
>безопасность при работе с хим реакциями определяется не знанием химии, а знанием ТБ
 258 Кб, 895x523
258 Кб, 895x523>А на схеме разве не контактный метод?
Он самый. Я его запостил, чтоб ты видел сколько там ебанины.
>SO2 это что, газ?
Да, сернистый газ.
>А можно SO2 озоном окислить?
Озон очень неустойчивое соединение, которое легко распадается на кислород и отдельный атом кислорода.
И проще использовать его для окисления сульфита меди до сульфата меди,
вместо того чтобы разлагать его нагреванием.
Сернистые соединения окисляются озоном до сернокислых.
Но сернистый газ с водой даёт сернистую кислоту: SO2 + H2O -> H2SO3
Можешь попытаться её озоном окислить: 3H2SO3 + O3 = 3H2SO4
>>34141
>Если бы мне понадобилась концентрированная соляная кислота на практике
Проще обычную соль, хлорид натрия в воде растворить,
подвергнуть электролизу (пик1), потом хлор спалить в водороде,
а хлороводород растворить в воде.
>я бы выпарил её из электролита
В электролитах, обычно - серная кислота. Из соляной кислоты хлороводород выкипит при 48 °C - тебе её не упарить.
Кстати, вот здесь, окислителем серы выступает не столько бром, сколько бромноватая кислота (HBrO3).
Реакция - такая: HBrO3 + H2O + S → HBr + H2SO4
Получается эта кислота из бромноватистой HBrO: 3HBrO -> HBrO3 + 2HBr,
которая в свою очередь образуется вместе с бромоводородом при реакции брома с водой: Br2+H2O -> HBr+HBrO.
Но концентрация бромноватой кислоты в бромной воде стремится к равновесию,
вследствие разложения этой бромноватой кислоты: HBrO3+5HBr -> 3Br2+3H2O
3 молекулы брома при этом дают снова 3 молекулы HBrO, и одну молекулу HBrO3, по реакциям выше.
А бромоводородная кислота медленно окисляется кислородом воздуха: 4HBr+O2 -> 2Br2+2H2O
>>34092 бромоводородная кислота, наверняка, могла бы быть окислена до брома или бромноватистой - при помощи озона.
 190 Кб, 1920x950
190 Кб, 1920x950Анон, объясни формулы. F понимаю, f тоже остальное понять не могу. Мозг уже не анализирует информацию, слишком долго учу.
>Проще обычную соль, хлорид натрия в воде растворить,
>подвергнуть электролизу (пик1),
И взорваться нахуй.
Попутно устроив соседям битву при Ипре.
>потом хлор спалить в водороде
И взорваться нахуй [2].
>а хлороводород растворить в воде.
Ты максимально уебанский способ получения соляной кислоты пытался найти? Поздравляю, у тебя почти получилось.
hn - потери давления (напора) при течении реальной жидкости от сечения 1 к сечению 2.
Потерянный напор измеряется в метрах жидкостного столба. Это там где hu у тебя.
g - ускорение свободного падения, м/с^2.
hc - глубина погружения.
ρ - плотность,
F - сила какая-то,
С, fb, wb - не знаю что это.
Хаххах, ну почему же?.. Водород прекрасно горит в хлоре: https://www.youtube.com/watch?v=vlpK-i-7-Bk
Если не делать гремучую смесь хлора с водородом и не облучать её светом - то водород сгорит в хлоре плавно, с образованием хлороводорода.
Можно его подать снизу из трубки на пьезоэлемент, а трубку - под слой воды засунуть, чтобы растворялся хлороводород.
А какой способ получения хлороводорода предложил бы ты?
Аппарат Киппа загружаем поваренной солью и серной кислотой достаточной концентрации. Выводную трубку - в склянку с водой. Булькаем до тех пор, пока вода не перестанет поглощать газ. Всё. Шанс взорваться нулевой, хлор вообще нигде не появляется, на выходе чистая солянка.
Ну так у этого же нет серной кислоты, а он хочет — соляную.
Я гляжу, по твоему способу - образуется гидросульфат натрия: NaCl+H2SO4 -> NaHSO4+HCl↑
Он, потом, может дать ещё больше хлороводорода, если спекать его с солью: NaHSO4+NaCl -> Na2SO4+HCl↑
Но он является отходом и расходует серную кислоту.
Гидросульфат натрия также может термически разлагаться и в пиросульфат (при 250 °C): 2NaHSO4 -> NaS2O7+H2O;
Который затем, при дальнейшем нагревании, возвращает часть серной кислоты - в виде SO3, (при 600 °C): Na2S2O7 -> Na2SO4+SO3↑;
Сульфат натрия уже не разлагается, но обратимо реагирует - с хлоридом магния, возвращая изначально вложенный хлорид натрия:
2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
Также, может использоваться и хлорид бария - здесь, выпадает осадок нерастворимого сульфата бария:
BaCl2+Na2SO4 -> BaSO4↓ +2NaCl
Дальше, сульфат магния может быть разложен термически (при 1137°C): 2MgSO4 -> 2MgO + 2SO2 + O2
Как и сульфат бария: 2BaSO4 -> 2BaO + 2SO2 + O2; - получаются их оксиды.
После чего возможна реакция спекания поваренной поваренной соли с оксидом, и возврат хлорида:
MgO + 2NaCl = MgCl2 + Na2O
2 NaCl + BaO = Na2O + BaCl2
Выделяющийся SO2 - может быть растворён в воде, с образованием сернистой кислоты, и дальнейшим окислением её в серную.
Но это целая ебанина и замкнутый цикл серной кислоты тут уже не построить.
Однако, по пути гуглежа, я нашёл ещё восстановление оксида бария из его хлорида - перегретым паром:
(900-950°C) BaCl2 + H2O → BaO + 2HCl
C оксидом магния - та же история: https://chemiday.com/reaction/3-1-0-7266
Реакция протекает при температуре около 500°C. MgCl2 + H2O → MgO + 2HCl
Поэтому из техпроцесса получения соляной кислоты может быть исключена серная кислота и сульфаты (гидросульфаты, пиросульфаты и прочее):
1. 2NaCl + BaO = Na2O + BaCl2 - нагревание, или спекание. Так получают оксид натрия, кстати. Судя по этой статье: http://www.onx.distant.ru/elements/11-Na_soed.html
2. BaCl2 + H2O → BaO + 2HCl↑ - перегретый пар на входе, хлороводород - на выходе.
3. ??????
4. Profit
Ну так у этого же нет серной кислоты, а он хочет — соляную.
Я гляжу, по твоему способу - образуется гидросульфат натрия: NaCl+H2SO4 -> NaHSO4+HCl↑
Он, потом, может дать ещё больше хлороводорода, если спекать его с солью: NaHSO4+NaCl -> Na2SO4+HCl↑
Но он является отходом и расходует серную кислоту.
Гидросульфат натрия также может термически разлагаться и в пиросульфат (при 250 °C): 2NaHSO4 -> NaS2O7+H2O;
Который затем, при дальнейшем нагревании, возвращает часть серной кислоты - в виде SO3, (при 600 °C): Na2S2O7 -> Na2SO4+SO3↑;
Сульфат натрия уже не разлагается, но обратимо реагирует - с хлоридом магния, возвращая изначально вложенный хлорид натрия:
2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
Также, может использоваться и хлорид бария - здесь, выпадает осадок нерастворимого сульфата бария:
BaCl2+Na2SO4 -> BaSO4↓ +2NaCl
Дальше, сульфат магния может быть разложен термически (при 1137°C): 2MgSO4 -> 2MgO + 2SO2 + O2
Как и сульфат бария: 2BaSO4 -> 2BaO + 2SO2 + O2; - получаются их оксиды.
После чего возможна реакция спекания поваренной поваренной соли с оксидом, и возврат хлорида:
MgO + 2NaCl = MgCl2 + Na2O
2 NaCl + BaO = Na2O + BaCl2
Выделяющийся SO2 - может быть растворён в воде, с образованием сернистой кислоты, и дальнейшим окислением её в серную.
Но это целая ебанина и замкнутый цикл серной кислоты тут уже не построить.
Однако, по пути гуглежа, я нашёл ещё восстановление оксида бария из его хлорида - перегретым паром:
(900-950°C) BaCl2 + H2O → BaO + 2HCl
C оксидом магния - та же история: https://chemiday.com/reaction/3-1-0-7266
Реакция протекает при температуре около 500°C. MgCl2 + H2O → MgO + 2HCl
Поэтому из техпроцесса получения соляной кислоты может быть исключена серная кислота и сульфаты (гидросульфаты, пиросульфаты и прочее):
1. 2NaCl + BaO = Na2O + BaCl2 - нагревание, или спекание. Так получают оксид натрия, кстати. Судя по этой статье: http://www.onx.distant.ru/elements/11-Na_soed.html
2. BaCl2 + H2O → BaO + 2HCl↑ - перегретый пар на входе, хлороводород - на выходе.
3. ??????
4. Profit
>Ну так у этого же нет серной кислоты
Серная кислота нужной концентрации получается из электролита простым упариванием.
>Он самый. Я его запостил, чтоб ты видел сколько там ебанины.
Так я знаю, сколько там ебанины. Поэтому и спрашивал про башенный метод, которым серную кислоту еще в средние века алхимики получали.
В средние века, алхимики разлагали железный купорос:
6FeSO4 -> Fe2(SO4)3 + 2Fe2O3 + 3SO2 - сульфат железа (III)
12FeSO4 + 3O2 -> 4Fe2(SO4)3 + 2Fe2O3; - окисление кислородом
При 900-1000°C протекает реакция: 2Fe2(SO4)3 -> 2Fe2O3 + 6SO2 + 3O2; - тут просто сернистый газ
А при температуре меньше 500-700 °C - уже другая: Fe2(SO4)3 -> Fe2O3 + 3SO3; - разложение в серный ангидрид
Ну а дальше: SO3 + H2O -> H2SO4; - серная кислота
Когда алхимики придумали серно-селитрянный способ получения серной кислоты,
они не прокаливали, а поджигали смесь селитры с серой под колоколом
который собирал отходящий газ и направлял его в воду,
источником серной кислоты была реакция вроде 3KNO3 + S = SO3 + 3KNO2
Но серный ангидрид получался только частично, другая часть серы уходила в SO2.
Вот так горит сера в расплаве ка селитры: https://www.youtube.com/watch?v=Ob3jgMc12K4
Башенный метод основан на реакции с ядовитым NO2: SO2 + NO2 + H2O = H2SO4 + NO
затем NO окисляется кислородом воздуха до NO2, и по-новой.
Можешь получить его так: FeCl2 + NaNO2 + 2HCl -> FeCl3 + NaCl + NO + H2O; но он тоже ядовит.
Человек. Может ты не будешь срать реакциями? Плиз. Это просто неприлично. Особенно такими простыми.
Я понимаю, что ты школьник, судя по знаниям. девятый класс, уровень муниципалки. Но пожалуйста. веди себя прилично. Тут есть знающие аноны, они могут тебе ответить на вопросы. Но ты срешь школьной хренью.
Иными словами, мы кекируем с тебя.
По-моему ты не тот анон, которому я ответил. И скорее срёшь здесь ты чем-то недообидным.
Ты хоть сам реакции понял? Если нет, то ты либо школьник, либо вообще с детсада вылез.
Нет у меня никаких вопросов в том посте.
Он спросил - я ответил. Ответил подробно. Реакции приложил.
Хотя может это была тонкая шутка такая, и я не вдуплил в иронию.
Пошёл нахуй, он тут единственный анон который отвечает популярно и доступно для всех и каждого. Побольше бы таких было. А отвечать на уровне "тебе нужна кислота, берёшь и делаешь, хули сложного" это уровень /b/. Надо видеть с чем имеешь дело, детализировать, расписывать, блять, а не халтурить а-ля "ну мы то все учоные в говне мочоные, знаем все".
>популярно и доступно для всех и каждого
Тебе в "тупые вопросы". Или в un/
Не просто так тут всё поделено, но люди продолжают одаривать вниманием.
Кстати, спроси ты в тупых вопросах, я бы сам всё подробно расписал.
А в этом треде, закономерно ссу в ебало.
Ordnung muss sein
>тупые вопросы тред
Какая высокомерная чмоня, ви посмотрите, ей неприятно видеть в треде про химию аж целые уравнения реакции.
Видимо ты настолько одарен, что химию на пальцах рассматриваешь. Отзеркалил мочу тебе в ебило, челядь.
Твоя ирония ни к чему. Школьные темы не для саентача.
>настолько одарен, что химию на пальцах рассматриваешь
Скилл, который есть у любого, кто хоть курс проучился на химическом факультете.
Так здесь не все на химфаке учились. Или для тебя химия-тред только для тех кто соответствующее образование имеет?
>Или для тебя химия-тред только для тех кто соответствующее образование имеет?
Главное иметь хоть какой-то начальный уровень. Если ты постигаешь основы, то очевидно надо писать в un/
Я считаю, что у тебя проблемы с пониманием прочитанного. Слепое следование ТБ без понимания СУТИ происходящего приводит к тому, что правила ТБ забываются на следующий день или искажаются. Например, человек увидит, как ТГФ чистят от пероксидов сухим KOH и подумает, что так можно делать всегда.
Или один увидел, как я делаю масс-спектры на прямом вводе образца в спектрометр, и решил, что МОЖЕТ ПОВТОРИТЬ. Сделал раствор протеина нужной концентрации, только, гений, забыл про бульон концентрацию буфера, в котором этот раствор готовился. Потом весь обслуживаемый участок спектрометра пришлось вилкой чистить, а сигнал от буфера исчез со спектров через несколько месяцев.
У тебя какое-то зашкаливающее чсв, дружище. Химия это всего лишь химия, а за высокомерие можно и в ебан получить ирл, между прочим. Не забывай что знания это для всех, и каждый волен получать их оттуда, откуда сочтёт нужным. Хочет - спрашивает у академика, хочет - у первокура или школьника, а про двач тут и говорить нечего, что это площадка для всех.
>Хочет - спрашивает у академика, хочет - у первокура или школьника, а про двач тут и говорить нечего, что это площадка для всех.
Ну иди спроси у академика. И если он пошет тебя, можешь ему в ебыч прописать.
Существует порядок. Треды разделены не просто так.
Первоклашки не учатся со старшеклассниками.
Если для тебя указание о порядке это чсв. Иди почини себе самооценку.
Просто призываю анонов, не отвечать тут на вопросы школьной программы, а перенаправлять в /un или в тупые вопросы.
И надо поменять шапку треда, это не шапка, а позорище для /sci.
>И надо поменять шапку треда, это не шапка, а позорище для /sci.
Надо. Но мы так и не определились с простым вопросом: ЕСЛИ НЕ ГЛИНКА, ТО КТО?
>ЕСЛИ НЕ ГЛИНКА, ТО КТО?
Ты про неоргу?
А это вообще обязательно? Тут одного учебника явно мало будет. Но точно не Глинка.
>И надо поменять шапку треда, это не шапка, а позорище для /sci.
+1, шапка неактуальна, попробовал зарепортить но что-то ошибку выдает.
Можно взять МГУшный учебник по неорге (Третьяков вроде?) + Гринвуд для аутистов и Браудер для омских синтезов. По органике - МакМерри/Кори/Терней + Органикум.
![img14[1].jpg](/sci/big/thumb/424574/15211189415840s.jpg) 38 Кб, 640x480
38 Кб, 640x480Мало того что ты флеймить сюда пришёл и оффтопить, нифига толком не ответил годного, так тебе ещё и шапка не нравится?
Запили новую давай, мы посмотрим, и при следующем перекате - возможно и запостим.
Указания какие-то принёс, про порядок типа... Сам вали на свои доски и другие треды.
Двач - свободное общение. И мы будем гуглить и копипастить то, что нам интересно.
У нас право на информацию. И да... Нас легион.
>>34060>>34061>>34063
>>34186
>Na2S2O7 -> Na2SO4+SO3↑
>>34200
>Fe2(SO4)3 -> Fe2O3 + 3SO3↑
>3KNO3 + S = SO3 + 3KNO2
Вот ещё нашёл разложение сульфатов, с выделением SO3:
K2S2O7 = K2SO4 + SO3↑
Реакция термического разложения дисульфата калия с образованием сульфата калия и оксида серы(VI).
Реакция протекает при температуре выше 440°C. Примеси: оксид серы(IV) SO2, кислород O2.
2ZnSO4 → Zn2OSO4 + SO3
Реакция термического разложения сульфата цинка с образованием оксида-сульфата цинка и оксида серы(VI).
Реакция протекает при температуре 600-800°C.
но выше - сульфат цинка разлагается уже так: 2ZnSO4 → 2ZnO + 2SO2 + O2
Реакция термического разложения сульфата цинка с образованием оксида цинка, оксида серы(IV) и кислорода.
Реакция протекает при температуре 930-1000°C.
SnSO4 → SnO + SO3
Реакция термического разложения сульфата олова(II) с образованием оксида олова(II) и оксида серы(VI).
Реакция протекает при температуре выше 360°C.
2VOSO4 → V2O5 + SO2 + SO3
Реакция термического разложения сульфата ванадила с образованием оксида ванадия(V), оксида серы(IV) и оксида серы(VI).
Реакция протекает при температуре 520-530°C.
3MnSO4 → Mn3O4 + 2SO3 + SO2
Реакция термического разложения сульфата марганца(II) с образованием оксида марганца(II,III), оксида серы(VI) и оксида серы(IV).
Реакция протекает при температуре 850-1155°C.
Sn(SO4)2 → SnO2 + 2SO3
Реакция термического разложения сульфата олова(IV) с образованием оксида олова(IV) и оксида серы(VI).
Реакция протекает при температуре 150-200°C.
Hf(SO4)2 → HfO2 + SO3
Реакция термического разложения сульфата гафния(IV) с образованием оксида гафния(IV) и оксида серы(VI).
Реакция протекает при температуре 500-800°C.
Что из этого всего проще получить??
Взор пал на K2SO4 + SO3 → K2S2O7, но сюда надо SO3 - изначально вложить.
Но есть реакция разложения гидросульфата аммония: NH4HSO4 → NH3↑ + SO3 + H2O
Реакция протекает при температуре выше 500°C. Примеси: оксид серы(IV) SO2, кислород O2.
И сульфат калия не реагирует ни аммиаком, ни с сернистым газом. Его можно было бы поставить как поглотитель SO3.
К тому же при разложении пиросульфата калия, примесей - нет: K2S2O7 -> K2SO4 + SO3↑
Дальше, гидросульфат аммония - разложением сульфата можно получить:
термическое разложение сульфата аммония (235-360 °C): (NH4)2SO4 -> NH4HSO4 + NH3↑
А его - пропусканием аммиака и оксида углерода(IV) через суспензию гипса:
CaSO4 + 2NH3 + CO2 + H2O → CaCO3 + (NH4)2SO4;
Итак, установка, в ней последовательно идут эти реакции:
1. CaSO4 + 2NH3 + CO2 + H2O → CaCO3 + (NH4)2SO4;
2. (235-360 °C): (NH4)2SO4 -> NH4HSO4 + NH3↑ - аммиак возвращается в 1.
3. NH4HSO4 → NH3↑ + SO3 + H2O - аммиак возвращается в 1, SO3 - поглощается поглотителем K2SO4, вода - конденсируется в 1;
4. Реакция поглощения поглотителем: K2SO4 + SO3 → K2S2O7
5. Разложение образовавшегося пиросульфата калия: K2S2O7 -> K2SO4 + SO3↑
6. Ну и серная кислота любой концентрации гидролизом серного ангидрида: SO3 + H2O -> H2SO4
Тут, на входе - гипс (CaSO4), углекислый газ (CO2).
Оборот аммиака замкнут внутри системы и поглощается сначала гипсом 1, затем возвращается в равных долях,
после прокаливания, сначала сульфата аммония 1, затем гидросульфата 2. С водой - то же самое, её подавать не надо.
На выходе - пиросульфат калия, который можно прокалить, извлекая SO3.
Суммарная реакция (формальное уравнение): CaSO4 + CO2 → CaCO3 + SO3;
____________________________________________________________________________________________________________________________________
Ещё смотрю, сульфат цинка может в SO3 разлагаться (выше написал 2ZnSO4 → Zn2OSO4 + SO3).
Только как его попроще так получить этот сульфат цинка?..
Ну... Можно медный купорос цинком восстановить: Zn + CuSO4 → ZnSO4 + Cu↓ но медь осядет.
Эту медь потом вот так >>34058 - в сульфат меди через сульфит, и вернуть сульфат меди.
А ещё, можно вместо разложения сульфата цинка (там что-то неведомое написано) -
провести его электролиз. Пикрелейтед. Цинк осядет на катод, а в растворе - серная кислота.
![img14[1].jpg](/sci/big/thumb/424574/15211189415840s.jpg) 38 Кб, 640x480
38 Кб, 640x480Мало того что ты флеймить сюда пришёл и оффтопить, нифига толком не ответил годного, так тебе ещё и шапка не нравится?
Запили новую давай, мы посмотрим, и при следующем перекате - возможно и запостим.
Указания какие-то принёс, про порядок типа... Сам вали на свои доски и другие треды.
Двач - свободное общение. И мы будем гуглить и копипастить то, что нам интересно.
У нас право на информацию. И да... Нас легион.
>>34060>>34061>>34063
>>34186
>Na2S2O7 -> Na2SO4+SO3↑
>>34200
>Fe2(SO4)3 -> Fe2O3 + 3SO3↑
>3KNO3 + S = SO3 + 3KNO2
Вот ещё нашёл разложение сульфатов, с выделением SO3:
K2S2O7 = K2SO4 + SO3↑
Реакция термического разложения дисульфата калия с образованием сульфата калия и оксида серы(VI).
Реакция протекает при температуре выше 440°C. Примеси: оксид серы(IV) SO2, кислород O2.
2ZnSO4 → Zn2OSO4 + SO3
Реакция термического разложения сульфата цинка с образованием оксида-сульфата цинка и оксида серы(VI).
Реакция протекает при температуре 600-800°C.
но выше - сульфат цинка разлагается уже так: 2ZnSO4 → 2ZnO + 2SO2 + O2
Реакция термического разложения сульфата цинка с образованием оксида цинка, оксида серы(IV) и кислорода.
Реакция протекает при температуре 930-1000°C.
SnSO4 → SnO + SO3
Реакция термического разложения сульфата олова(II) с образованием оксида олова(II) и оксида серы(VI).
Реакция протекает при температуре выше 360°C.
2VOSO4 → V2O5 + SO2 + SO3
Реакция термического разложения сульфата ванадила с образованием оксида ванадия(V), оксида серы(IV) и оксида серы(VI).
Реакция протекает при температуре 520-530°C.
3MnSO4 → Mn3O4 + 2SO3 + SO2
Реакция термического разложения сульфата марганца(II) с образованием оксида марганца(II,III), оксида серы(VI) и оксида серы(IV).
Реакция протекает при температуре 850-1155°C.
Sn(SO4)2 → SnO2 + 2SO3
Реакция термического разложения сульфата олова(IV) с образованием оксида олова(IV) и оксида серы(VI).
Реакция протекает при температуре 150-200°C.
Hf(SO4)2 → HfO2 + SO3
Реакция термического разложения сульфата гафния(IV) с образованием оксида гафния(IV) и оксида серы(VI).
Реакция протекает при температуре 500-800°C.
Что из этого всего проще получить??
Взор пал на K2SO4 + SO3 → K2S2O7, но сюда надо SO3 - изначально вложить.
Но есть реакция разложения гидросульфата аммония: NH4HSO4 → NH3↑ + SO3 + H2O
Реакция протекает при температуре выше 500°C. Примеси: оксид серы(IV) SO2, кислород O2.
И сульфат калия не реагирует ни аммиаком, ни с сернистым газом. Его можно было бы поставить как поглотитель SO3.
К тому же при разложении пиросульфата калия, примесей - нет: K2S2O7 -> K2SO4 + SO3↑
Дальше, гидросульфат аммония - разложением сульфата можно получить:
термическое разложение сульфата аммония (235-360 °C): (NH4)2SO4 -> NH4HSO4 + NH3↑
А его - пропусканием аммиака и оксида углерода(IV) через суспензию гипса:
CaSO4 + 2NH3 + CO2 + H2O → CaCO3 + (NH4)2SO4;
Итак, установка, в ней последовательно идут эти реакции:
1. CaSO4 + 2NH3 + CO2 + H2O → CaCO3 + (NH4)2SO4;
2. (235-360 °C): (NH4)2SO4 -> NH4HSO4 + NH3↑ - аммиак возвращается в 1.
3. NH4HSO4 → NH3↑ + SO3 + H2O - аммиак возвращается в 1, SO3 - поглощается поглотителем K2SO4, вода - конденсируется в 1;
4. Реакция поглощения поглотителем: K2SO4 + SO3 → K2S2O7
5. Разложение образовавшегося пиросульфата калия: K2S2O7 -> K2SO4 + SO3↑
6. Ну и серная кислота любой концентрации гидролизом серного ангидрида: SO3 + H2O -> H2SO4
Тут, на входе - гипс (CaSO4), углекислый газ (CO2).
Оборот аммиака замкнут внутри системы и поглощается сначала гипсом 1, затем возвращается в равных долях,
после прокаливания, сначала сульфата аммония 1, затем гидросульфата 2. С водой - то же самое, её подавать не надо.
На выходе - пиросульфат калия, который можно прокалить, извлекая SO3.
Суммарная реакция (формальное уравнение): CaSO4 + CO2 → CaCO3 + SO3;
____________________________________________________________________________________________________________________________________
Ещё смотрю, сульфат цинка может в SO3 разлагаться (выше написал 2ZnSO4 → Zn2OSO4 + SO3).
Только как его попроще так получить этот сульфат цинка?..
Ну... Можно медный купорос цинком восстановить: Zn + CuSO4 → ZnSO4 + Cu↓ но медь осядет.
Эту медь потом вот так >>34058 - в сульфат меди через сульфит, и вернуть сульфат меди.
А ещё, можно вместо разложения сульфата цинка (там что-то неведомое написано) -
провести его электролиз. Пикрелейтед. Цинк осядет на катод, а в растворе - серная кислота.
>Двач - свободное общение. И мы будем гуглить и копипастить то, что нам интересно.
>У нас право на информацию. И да... Нас легион.
Бан бы тебе прописать. Всю доску засрал.
>мы посмотри
Кто мы? Ты с кем разговариваешь? Мы тут с тобой одни сидим.
>>34449
Да, неорга тетьякова + Гринвуд очень неплохо. Можно еще вкинуть теоретическую химию Хьюи и Коттона Уилкенсона учебник.
Химия твердого тела (конкретно - твердые растворы), физ. химия.
Никак не спрятать. Но если вещество сложное, то его действительно сложно воспроизвести. Синтезы то можно на коленках придумывать. Да вот у них там выходы будут в идеальном случае 1%
Сложно воспроизводятся как правило лишь вещи с хитровыебанной микроструктурой, которая сформировалась за счёт никому не известного процесса. Скажем, какой-нибудь хитрый сплав - вроде все компоненты известны, и элементный состав определяется элементарно, но вот как сделать конкретно такой образец, с конкретно таким распределением и структурой фаз, зачастую так просто не выяснишь. А если это какая-то органическая хуйня добиологической степени сложности, то при установлении структуры синтез в общем-то становится делом техники.
если капнуть условный "Новичок" в сложный борщ, как его там найти и воспроизвести, если ты не знаешь заранее, что ищешь?
Остальные компоненты можно отделить и идентифицировать, если они уже известны.
Владимир Владимирович, залогиньтесь. Из смеси экстрагируется органика, потом разделяется в хроматографе, и с помощью масс-спектрометра идентифицируются конкретные вещества. Что ищут - известно, ищут нервно-паралитическое ОВ, это в 99% случаев фосфорорганика.
>AAS sampling
Атомно-абсорбционная спектроскопия.
https://ru.wikipedia.org/wiki/Спектральный_анализ
А ещё вот здесь >>429879, иглой атомно-силового микроскопа - даже водородные связи пощупали, и измерили их силу, без разрыва их.
 1,3 Мб, 2133x1600
1,3 Мб, 2133x1600Помогите плез, а то я тупой и даже в Гугле ничего толкового найти не смог
>Линканул бы сразу статью об атомно-абсорбционной спектроскопии.
Да, вот она на русском: https://ru.wikipedia.org/wiki/Атомно-абсорбционная_спектрометрия
и на английском: https://en.wikipedia.org/wiki/Atomic_absorption_spectroscopy
>>34720
>Помогите плез, а то я тупой и даже в Гугле ничего толкового найти не смог
А ты по картинкам в гугле посмотри. На пик1 - механизм образования координационной связи в ионе аммония.
>Соединение, имеющие координационную связь: NaCl, NH3, H3O, CO2
Ион H3O+. Пикрелейтед.
Гидроксоний (оксоний, гидроний) НзО+ — комплексный ион, соединение протона с молекулой воды.
http://www.himikatus.ru/art/ch-act/0092.php
Многоатомные ионы, как, например, ион аммония NH4+ или ион оксония H3O+
(последний известен также под названием ион гидроксония),
содержат координационные связи наряду с обычными ковалентными связями.
Спасибо, анончик, выручил пиздец
Тем, что мясо-рыба при 60 всяко лучше будет, а вода так не умеет, мультиварка тоже перегревает.
Сделай импровизированный тогда. Например, с помощью связки ТЭН-регулятор мощности. Чтобы не было перегрева - грей через "рубашку" из трансформаторного масла. Я так самогонный аппарат запитал.
Если будешь использовать низкокипящую жидкость - она будет испаряться, и пары надо будет куда-то девать.
Пары большинства низкокипящих растворителей токсичны и/или пожароопасны. А некоторые еще и могут проникать сквозь пакетик с хавкой.
Не, ну мультиварка более-менее может, если поставить целевую температуру на 10-15ниже и каждые 10 минут смотреть. Я хз, как до датчика в крышке добраться и есть ли он вообще там, может, попробовать к нему кусок меди, опускаемый в воду прилепить для точности.
 15 Кб, 450x450
15 Кб, 450x450Конечно 10 класс, если правда химия интересна. А если о техникуме так говорят, значит это обычное пту с красивым названием.
Попробуй в горячий р-р щелочи добавить перекиси, и закинь йод, реакция пройдёт как раз с образованием NaI, если уж йодат и образуется, то можно прокалить при температуре >500 или железа добавить, если есть доступ к химмагам, то можно металлического натрия купить и напрямую сплавить с йодом
Зачем греть? Щелочной раствор йода с перекисью реагирует и при комнатной температуре.
H2O2 здесь восстановитель
Я ссылался на прошлую похожую реакцию с гидроксидом натрия, и йод дописывать не стал
>А с иодидом калия что-то можно придумать?
Во-перых, можешь использовать его как лекарственное средство:
https://ru.wikipedia.org/wiki/Йодид_калия_(лекарственное_средство)
Во-вторых,
Иод — редкий элемент. Его кларк — всего 400 мг/т.
И ты можешь получить из него элементарный йод.
Либо электролизом, либо осаждением при помощи хлорида железа,
KI+FeCl3=I2+FeCl2+KCl:
https://www.youtube.com/watch?v=jMZtNtTB44o
Затем, можешь растворить йод в самом йодиде калия, он хорошо растворится.
так как йод - лучше растворяется в водных растворах иодидов щелочных металлов
с образованием трииодидов (например трииодида калия KI3).
Так, можешь сделать ещё и раствор Люголя, а потом трийодид калия,
в глицерине растворить. Тоже лекарсвенное средство.
Здесь больше атомо йода на 1 атом калия.
А ещё, можешь йод - в спирте растворить (бурый раствор, пик1) и в ампулу запаять,
или просто в виде кристаллов - в ампулу. Будет кристаллический йод. Пик2.
Только йод, хоть и редкий, но он ядовит: Смертельная доза (LD50) — 3 г.
ПДК иода в воде 0,125 мг/дм3, в воздухе 1 мг/м3.
Мировое потребление иода в 2005 году составило 25,8 тыс. тонн.
Для человека среднего возраста нормальной комплекции (нормостеник) - суточная доза
иода составляет 0,15 мг.
Можешь с аммиаком сделать взрывную бумагу, получив нитрид трийода или его аддукт:
3I2 + 5NH4OH → 3NH4I + NH3•NI3↓ + 5H2O
и сам нитрид трийода из него:
NH3·NI3 + 3Zn(C2H5)2 → NH3 + N(C2H5)3 + 3ZnC2H5I
https://www.youtube.com/watch?v=P8334vJZlds и использовать его в пиротехнике.
Нитрид трийода, представляет собой чёрные кристаллы, очень чувствительные к механическим воздействиям.
В сухом виде - взрывается от прикосновения, образуя розовато-фиолетовое облако паров йода.
Это единственное вещество, которое взрывается под воздействием альфа-частиц и других продуктов ядерного распада.
Поэтому, наерняка, можно использовать его как индикатор радиации для дозиметров,
измеряя дозу альфа-излучения - по концентрации паров йода.
Разлагая нитрид трийода можно получить оксид азота (III): 2NI3 + 3H2O → 6HI + N2O3
а значит, через его термическое разложение N2O3 -> NO+NO2,
или взаимодействие с водой: N2O3+H2O -> 2HNO2 можно получить азотистую
и азотную кислоту. Оксид азота (II), NO, тотчас же реагирует с кислородом: 2NO+O2 -> 2NO2
В водных растворах существует равновесие: 2HNO2 ⇄ N2O3 + H2O ⇄ NO↑ + NO2↑ + H2O
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты: 3HNO2 ⇄ HNO3 + 2NO↑ + H2O
При этом, HI, образовавшаяся при гидролизе нитрида трийода - может быть снова конвертирована в изначальный KI - йодид калия.
Алсо, в криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
Да и вообще, посмотри тут, где он нужен этот йод: https://ru.wikipedia.org/wiki/Иод#Применение
>А с иодидом калия что-то можно придумать?
Во-перых, можешь использовать его как лекарственное средство:
https://ru.wikipedia.org/wiki/Йодид_калия_(лекарственное_средство)
Во-вторых,
Иод — редкий элемент. Его кларк — всего 400 мг/т.
И ты можешь получить из него элементарный йод.
Либо электролизом, либо осаждением при помощи хлорида железа,
KI+FeCl3=I2+FeCl2+KCl:
https://www.youtube.com/watch?v=jMZtNtTB44o
Затем, можешь растворить йод в самом йодиде калия, он хорошо растворится.
так как йод - лучше растворяется в водных растворах иодидов щелочных металлов
с образованием трииодидов (например трииодида калия KI3).
Так, можешь сделать ещё и раствор Люголя, а потом трийодид калия,
в глицерине растворить. Тоже лекарсвенное средство.
Здесь больше атомо йода на 1 атом калия.
А ещё, можешь йод - в спирте растворить (бурый раствор, пик1) и в ампулу запаять,
или просто в виде кристаллов - в ампулу. Будет кристаллический йод. Пик2.
Только йод, хоть и редкий, но он ядовит: Смертельная доза (LD50) — 3 г.
ПДК иода в воде 0,125 мг/дм3, в воздухе 1 мг/м3.
Мировое потребление иода в 2005 году составило 25,8 тыс. тонн.
Для человека среднего возраста нормальной комплекции (нормостеник) - суточная доза
иода составляет 0,15 мг.
Можешь с аммиаком сделать взрывную бумагу, получив нитрид трийода или его аддукт:
3I2 + 5NH4OH → 3NH4I + NH3•NI3↓ + 5H2O
и сам нитрид трийода из него:
NH3·NI3 + 3Zn(C2H5)2 → NH3 + N(C2H5)3 + 3ZnC2H5I
https://www.youtube.com/watch?v=P8334vJZlds и использовать его в пиротехнике.
Нитрид трийода, представляет собой чёрные кристаллы, очень чувствительные к механическим воздействиям.
В сухом виде - взрывается от прикосновения, образуя розовато-фиолетовое облако паров йода.
Это единственное вещество, которое взрывается под воздействием альфа-частиц и других продуктов ядерного распада.
Поэтому, наерняка, можно использовать его как индикатор радиации для дозиметров,
измеряя дозу альфа-излучения - по концентрации паров йода.
Разлагая нитрид трийода можно получить оксид азота (III): 2NI3 + 3H2O → 6HI + N2O3
а значит, через его термическое разложение N2O3 -> NO+NO2,
или взаимодействие с водой: N2O3+H2O -> 2HNO2 можно получить азотистую
и азотную кислоту. Оксид азота (II), NO, тотчас же реагирует с кислородом: 2NO+O2 -> 2NO2
В водных растворах существует равновесие: 2HNO2 ⇄ N2O3 + H2O ⇄ NO↑ + NO2↑ + H2O
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты: 3HNO2 ⇄ HNO3 + 2NO↑ + H2O
При этом, HI, образовавшаяся при гидролизе нитрида трийода - может быть снова конвертирована в изначальный KI - йодид калия.
Алсо, в криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
Да и вообще, посмотри тут, где он нужен этот йод: https://ru.wikipedia.org/wiki/Иод#Применение
А не пошёл бы ты, да прямиком туда?
Я по делу написал-то. Ты же флеймишь и оффтопишь.
Ну что за хуйня, сидишь печатаешь длиннющий ответ как поц, а тут - какая-то срань в ответ.
Сходи на самиздат, там такие как ты (больные) терабайты текста пишут, а на них ссут и срут. Потому что количество не переходит в качество, а вовсе даже наоборот.
Я написал, что можно делать с йодидом калия и дальше уже - с йодом.
Ты же нихуя не написал (возможно про перекись это был ты),
но ты же ещё и про качество что-то попёрдываешь.
Если количество тут перейдёт в качество - ты можешь травануться нахуй этим йодом,
в йодной яме ядерного реактора, блядь.
Там йод с самой перекисью реагирует с образованием йодноватой кислоты (HIO3): I2 + H2O2 = HIO3 + H2O
и может образоваться йодат: NaOH + HIO3 → H2O + NaIO3
То есть, чистый йодид не получить, и прийдётся химичить либо термически разлагая йодат, как ты сказал,
либо железом, расходуя тут и железо и перекись: 2Fe + NaIO3 + H2O2 → NaI + 2FeO(OH)
Это реакция взаимодействия железа, иодата натрия и пероксида водорода
с образованием иодида натрия и метагидроксида железа. Реакция протекает при кипении на воздухе.
Но...
>>35452
Вот наилучший метод, на мой взгляд: http://znaesh-kak.com/na/natrii/jodid-natriya.html
2NaOH + I2 + H2S = 2NaI + S↓ + 2H2O, и в общем виде это реакция нейтрализации.
При этом, сероводород с йодом - лабораторный метод получения
растворимого в воде (и растворе щелочи) йодоводорода:
H2S+I2 -> S+2HI с образованием йодоводородной кислоты.
Затем, эта кислота - просто гасит щелочь и не должно быть никаких йодатов.
Но йод, реагируя с водой раствора щелочи, может дать не только йодоводород,
но и йодноватистую кислоту (HIO), которая разлагается в йодноватую: 5HIO -> HIO3+2I2+2H2O,
и она-таки может дать в йодиде - примесь йодат.
Но я ещё нашёл такое видео, с хлором: https://www.youtube.com/watch?v=TofDJorxkHM
Там в конце, показаны - две реакции:
Na2S + HCl -> 2NaCl + H2S↑ - сначала приливают мутный раствор сульфида натрия;
Cl2 + H2S -> S↓ + 2HCl - затем, сероводород поглощается, а хлороводород возвращается.
И сразу после этого видео, подумалось сначала о йоде вместо хлора,
а затем пришла мысль о прямой реакции сульфида натрия с йодом,
без всякого сероводорода и йодоводородной кислоты.
И она, такая реакция, есть: Na2S+I2=2NaI+S↓
Как видишь, на предыдущем видео, сульфид натрия - в растворе. Он со временем мутнеет (коллоидная сера).
Поэтому в такой раствор, просто можно просто закинуть кристаллический йод.
Сам сульфид натрия - получают при прокаливании, восстановлением сульфата натрия,
либо водородом: Na2SO4+4H2 -> Na2S+4H2O
либо углём: Na2SO4+4C -> Na2S + 4CO
либо угарным газом: Na2SO4+4CO -> Na2S + 4CO2
или же метаном: Na2SO4 + CH4 = Na2S + CO2 + 2H2O
Итак, после всего этого, чистый йодид натрия может получаться так: Na2S+I2=2NaI+S↓
Там йод с самой перекисью реагирует с образованием йодноватой кислоты (HIO3): I2 + H2O2 = HIO3 + H2O
и может образоваться йодат: NaOH + HIO3 → H2O + NaIO3
То есть, чистый йодид не получить, и прийдётся химичить либо термически разлагая йодат, как ты сказал,
либо железом, расходуя тут и железо и перекись: 2Fe + NaIO3 + H2O2 → NaI + 2FeO(OH)
Это реакция взаимодействия железа, иодата натрия и пероксида водорода
с образованием иодида натрия и метагидроксида железа. Реакция протекает при кипении на воздухе.
Но...
>>35452
Вот наилучший метод, на мой взгляд: http://znaesh-kak.com/na/natrii/jodid-natriya.html
2NaOH + I2 + H2S = 2NaI + S↓ + 2H2O, и в общем виде это реакция нейтрализации.
При этом, сероводород с йодом - лабораторный метод получения
растворимого в воде (и растворе щелочи) йодоводорода:
H2S+I2 -> S+2HI с образованием йодоводородной кислоты.
Затем, эта кислота - просто гасит щелочь и не должно быть никаких йодатов.
Но йод, реагируя с водой раствора щелочи, может дать не только йодоводород,
но и йодноватистую кислоту (HIO), которая разлагается в йодноватую: 5HIO -> HIO3+2I2+2H2O,
и она-таки может дать в йодиде - примесь йодат.
Но я ещё нашёл такое видео, с хлором: https://www.youtube.com/watch?v=TofDJorxkHM
Там в конце, показаны - две реакции:
Na2S + HCl -> 2NaCl + H2S↑ - сначала приливают мутный раствор сульфида натрия;
Cl2 + H2S -> S↓ + 2HCl - затем, сероводород поглощается, а хлороводород возвращается.
И сразу после этого видео, подумалось сначала о йоде вместо хлора,
а затем пришла мысль о прямой реакции сульфида натрия с йодом,
без всякого сероводорода и йодоводородной кислоты.
И она, такая реакция, есть: Na2S+I2=2NaI+S↓
Как видишь, на предыдущем видео, сульфид натрия - в растворе. Он со временем мутнеет (коллоидная сера).
Поэтому в такой раствор, просто можно просто закинуть кристаллический йод.
Сам сульфид натрия - получают при прокаливании, восстановлением сульфата натрия,
либо водородом: Na2SO4+4H2 -> Na2S+4H2O
либо углём: Na2SO4+4C -> Na2S + 4CO
либо угарным газом: Na2SO4+4CO -> Na2S + 4CO2
или же метаном: Na2SO4 + CH4 = Na2S + CO2 + 2H2O
Итак, после всего этого, чистый йодид натрия может получаться так: Na2S+I2=2NaI+S↓
Спасибо, дружище!
Пожалуйста, съеби, пан ёбаный шизик.
Попался мне на глаза документ хим анализа воды фуджи, вопрос : можно ли ее изготовить в домашних условиях? Как? Меня смущает слишком большое количество анионов бикарбонатов + силикатов и при этом как-то мало ионов металлов. Куда копать?
По заряду не сходится? Пересчитай в молях, не забудь про гидролиз анионов слабых кислот.
>По заряду не сходится?
Нет. Сорри я хз как это проверить, у меня познания химии на уровне восьмого класса.
Но из растворимых в воде силикатов тут только силикаты натрия и калия и если взять массу анионов SiO3 96 mg/L и дополнить его натрием, как если бы это была соль вне водного раствора Na2SiO3, то ионов натрия получается значительно больше (58 mg/l) чем указано в результатах анализа 18 mg/L.
Вполне вероятно, что я написал лютейшую дичь, буду очень признательным если напишешь список тем которые мне нужно изучить прежде чем пытаться что-то делать. Как искусственно создаются подобные растворы?
Вообще, silica - это не силикат, а оксид кремния. В воде он будет существовать в форме SiO2*H2O. Разумеется, эта форма будет находится в равновесии с силикат-ионом, но анализ может этого не показывать. Та же хуйня с карбонатами, они в равновесии с CO2. Можно посмотреть константы равновесия и посчитать истинную концентрацию диссоциированного иона, но зачем?
Наконец, в своей мемной бумажке они могут написать любую хуиту, особенно по unreglated compounds. Я, например, авторитетно заявляю, что в моей воде из-под крана 0.0 нг/л технеция и калифорния.
Берешь хорошо растворимые соли в нужной концентрации, всякую малорастворимую гидролизующуюся муть типа силикатов подгоняешь ЭМПИРИЧЕСКИМ ПУТЕМ.
Готовишь раствор (пропускаешь угл. газ через суспензию мела в воде), проверяешь его концентрацию, добавляешь нужное количество к раствору других солей.
Конечно, тебе потребуется дистиллированная вода, полученная без использования металлических и стеклянных дистилляторов, изоляция растворов от атмосферы и корректировка теоретически рассчитанных количеств солей. А - аутизм.
Концентрация растворов, гидролиз солей, буферные растворы, практикум по аналитической химии.
Можно сделать чтоб вот эта вот хуйня:
https://youtu.be/lWxTsnaDPZQ
не плавилась от нагревания после того как 1 раз застынет?
Нельзя, нужен специальный полимер. В английском их называют thermosetting, как в русском - не знаю. В основном, композиты на основе фенолформальдегидной смолы, эпоксидной смолы, полиуретана и т.п.
Спасибо.
Если решили выучить химию с нуля - лучше начать именно с нее.
>Учебник по органике
Вот. Но вообще все реакции ты не сможешь выяснить. По одним только альдегидам есть огромный том на немецком.
Как бы тебе сказать. Самих реакций уйма, но надо смотреть в механизм. Так как элементарных актов, из которых строится реакция НАМНОГО меньше.
>>36935
Учитывая, сколько катализаторов и различных веществ есть в органике, все ты однозначно предугадать не сможешь. Даже исходя из «полного знания всех основных групп» — речь, надеюсь, о функциональных?
Вообще говоря, чтобы «выводить реакционную способность из свойств», можно почитать какого-нибудь Клэйдена (или более продвинутый учебник по органике вроде Марча — c самого начала, где разделы про механизмы). Более того, не только эти два, но и почти все остальные учебники, Курц тот же, как раз отсортированы именно по функциональным группам и какое-никакое количество материалов по протекающим реакциям дают. Абсолютной полноты нигде, кроме справочников (и то не всех) или БД, нет, да и кому она нужна, лол; впрочем, какое-то понимание они дадут.
>элементарных актов, из которых строится реакция НАМНОГО меньше.
Ну вот, я примерно об этом. Есть же основные вещи, из которых можно вывести все остальное?
>>36937
Спасибо за конкретных авторов. Мне не столько абсолютная полнота нужна, сколько интересно, можно ли ее вывести из неких основных механизмов.
Oxford Chemistry Primers, например. Есть еще сборники синтезов, в т.ч. и онлайновые (reaxys).
>>36935
Выводятся, но на практике все не так гладко, как на бумаге. Например, выясняется, что грязный продукт дохнет на колонке и его хуй почистишь. Или выходит синтез в 10 стадий с выходом в 60% на каждой из них. Или в литературе описан только неповторимый КИТАЙСКИЙ СИНТЕЗ.
>Есть же основные вещи, из которых можно вывести все остальное?
Да, такое есть. Хотя существуют реакции в которых без бутылки или если у тебя ОХУЕННАЯ химическая интуиция не разберешься. Часто только эксперимент или комп поможет выснить какой путь реакции предпочтительнее. Как пример, та же реакция Виттига, механизм там очень тонко меняется от условий.
Еще Лоури "Механизм и теория в орг. химии", Беккер "Введение в электронную теорию органических реакций". Но да, в учебниках уровня Advanced organic chemistry довольно подробно механизмы рассматривают.
>>36938
>Есть же основные вещи, из которых можно вывести все остальное?
Да, есть. Уравнение Шредингера, лол.
 44 Кб, 604x483
44 Кб, 604x483>Уравнение Шредингера,
Ну вот, уже что-то. Всю (органическую) химию из него можно вывести, или есть еще другие связи / исключения?
 77 Кб, 400x207
77 Кб, 400x207Практически ВСЮ химию можно из него вывести.
А где не хватит и надо релятивизм учесть, бери уравнение Дирака.
Но где ты комп то возьмешь, который тебе такое посчитает? Раствор то хер посчитаешь.
Допустим, можно посчитать для компонентов реакции, н-р 2 реагента и раствор, всего 3 молекулы, свойства которых прямо выводятся из уравнения Шредингера.
Уравнение Шредингера решено только для изолированных атомов (когда я учился - вообще только для изолированного атома водорода. Может, и для других атомов уже решили). В химии используется упрощенная модель (форма орбиталей посчитана для атома водорода, электроны валентной сферы не взаимодействуют с другими) - теория молекулярных орбиталей (которые являются т.н. линейной комбинацией атомных орбиталей ЛКАО - тоже упрощенная модель). Соответственно, реакции - это взаимодействия МО разных молекул. Если мы знаем, что происходит в ходе реакции, обосновать это с т.з. теории МО довольно просто. Обратный процесс не настолько тривиален и не всегда дает правильный результат.
 23 Кб, 506x556
23 Кб, 506x556> реакции - это взаимодействия МО разных молекул. Если мы знаем, что происходит в ходе реакции, обосновать это с т.з. теории МО довольно просто. Обратный процесс не настолько тривиален и не всегда дает правильный результат.
А как это считают? Я просто подумал, что все это можно прямо представить в теории типов, тогда электрон представляется уравнением Шредингера, хим.элемент можно представить в виде зависимого типа, а реакцию - функцией из одного типа в другой. Т.е хим.реакцию можно рассматривать как теорему, доказать которую можно в любом прувере, Idris, Coq, Agda итд.
>всего 3 молекулы
Тебе надо будет для более менее хорошей точности(это не учитывая, что все методы неточные, точных решений уравнения нет), взять клетку раствора с парой сотен молекул растворителя. Тремя ты не отделаешься, а сложность растет экспоненциально.
>в школьных учебниках
Дальше точек и гибридизации не заходят. Школьные учебники ужасные, в химию вкатиться не просто, а химии всего час. А где её больше, так это в хим.био. классах, эти же не знают физики, и поэтому не могут понимать химию по определению.
> (это не учитывая, что все методы неточные, точных решений уравнения нет),
Нечёткая логика жи есть.
> Аналитическое решение уравнения Шредингера для большинства случаев не подвезли.
А в чем конкретно сложность, почему не подвезли?
> В упрощенном виде то, о чем ты говоришь - это всякие правила Хюккеля, разрешенность реакций по симметрии и т.п.
Это же все есть в учебниках, которые выше советовали?
> Лысые обезьянки слишком тупые, только в этом.
Не, должны быть какие-то подводные камни. У Марча написано, что уравнение Шрёдингера это дифур, но сейчас же на каждом углу полно солверов дифуров, даже стохастических, если нужно, никому это на бамажке в столбик считать не придётся.
>А в чем конкретно сложность, почему не подвезли?
Нет точной формулы всех знаков числа пи. Надо высчитывать рядами. Там похожая фигня. У тебя это диффур. А не у всех диффуров есть решение аналитическое.
Ну если не точное решение, то хотя бы аппроксимация решения, с достаточной для практических целей точностью же возможна? Вот тут http://www.jetpletters.ac.ru/ps/2113/article_31750.pdf пишут, что нашли аналитическое решение для многоэлектронных атомов.
>в приближении
Апроксимации есть, целая куча вариантов как решать. Программы есть. бери да считай.
Так я в душе не ебу, что конкретно гуглить. Какой есть софт, онлайн-сервисы, что-то еще?
Ты про расстановку коэффициентов?
>>36964
Если учитывать взаимодействие электронов, нужно решать систему ДУ в частных производных. Аналитического решения эта система вообще может не иметь, поэтому используют численные методы, которые довольно ресурсоемки.
Похожая ситуация, кстати, в сопромате механике деформируемого твердого тела. Там численными методами компоненты тензора деформации находят (в свое время применение ЭВМ и численных методов произвело революцию в механике материалов)
>Это же все есть в учебниках, которые выше советовали?
В упрощенном виде.
 3,8 Мб, 3616x2832
3,8 Мб, 3616x2832Алсо, по какому принципу рисуются узловые поверхности? На каждом следующем энерг. уровне их должно быть на 1 больше (уменьшается связывание), и при этом они не должны располагаться несимметрично, я правильно понимаю?
>В чем физический смысл узловых поверхностей, проходящих через атомы углерода?
В узловой поверхности волновая функция равна нулю. Как ты понимаешь электронная плотность тоже, но электроны получают выгоду только между ядер, поэтому узловые поверхности это всегда плохо для энергии, чем их больше, тем выше.
>Можно ли сказать, что p-орбиталь с электроном у этого атома сохраняется (если да, как ее отобразить)?
>Алсо, по какому принципу рисуются узловые поверхности? На каждом следующем энерг. уровне их должно быть на 1 больше (уменьшается связывание), и при этом они не должны располагаться несимметрично, я правильно понимаю?
Качай книгу Харгиттаи симметрия глазами химика. Там все ответы. Нет, p орбиталь не сохранилась(её и изначально то не было, это лишь приближение такое, электроны нельзя поделить на орбитали, они неотличимы).
Ты кусок говна.(Так как Глинка для домохозяйек).Открываешь Третьякова несколько томов,открываешь Робертса и Косерио.Пашешь,так что волосы на голове зеленеют в лаборатории.Глинка для туалетной бумаги.Бесят такие ребята меня.Нахрен оно Вам нужна эта химия,даже прекурсоры не получите.Насмотритеть смоих сериалов Во все тяжкие и давай мечтать.Делать больше нечего.
Доставка хрупких стекляшек не стоит жутких денег? А реагенты не завернут обратно, сейчас все посылки по закону досматривают вроде.
какую тему проходите?
Лет 5 назад во всяких русхимах можно было тот же натрий килограммами покупать без регистрации и СМС, сейчас что-то поменялось?
Затаривал домой всякие там алюминиевые пудры и дихроматы калия. Посылка доехала, СБУ їїїїїї не приезжало.
Хотя, конечно, хз, можно ли так, лол.
Пишу диссертацию на тему" очистка воды от азота и фосфора", смотрю различные схемы очистки, везде почти ставят денитрификацию перед нетрификацией? Почему? По идее, в конечном результате должно быть как можно меньше нитратов, а нитрификация наоборот их создает, так как из нитритов превращает в нитраты, в чем прикол? Либо я что-то не понимаю.
Вопрос - нужно ли это? Так ли необходимы практические знания ? Если да - то как лучше к этому подойти ? Реально ли выполнять всё в домашних условиях и при небольшом бюджете ?
А можно имя лектора ?
Задачи обязательно решай, это простейший способ научиться думать в химических категориях, хоть задачи и не всегда близки к реальности. В зависимости от твоих целей, практика может быть очень полезна - химия однозначно экспериментальная наука. С какими-то простейшими вещами сможешь поиграться дома гугли Гроссе, Вайсмантель - "Химия для любознательных". Настольная книга юных химиков былых лет, но сейчас раздобыть многие реагенты будет сложно, кругом одни параноики. Но вообще рекомендуется найти доступ к лаборатории хотя бы школьного уровня.
Да не, нормальный нитрит натрия, он солидным химиком был. Да и может он и не из НИИ его спиздил, я вообще не ебу, где он это взял.
Глянь в первых главах "Ларри Гоник "ХИМИЯ. ЕСТЕСТВЕННАЯ НАУКА В КОМИКСАХ", там очень доступно.
За книжку огромное спасибо - это именно то, что я искал.
Доступ к хорошей лабе у меня есть, но пока не хочу приставать по пустякам, т.к. этот интерес к химии может пропасть через пару дней, что очень часто у меня и бывает.
 66 Кб, 680x491
66 Кб, 680x491Это осадок.
1. Растворение серебра в азотной кислоте: https://www.youtube.com/watch?v=1dCCYyku3WQ
Ag+2HNO3 -> AgNO3+NO2↑+H2O
2. Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты,
поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра,
нерастворимого в азотной кислоте:
HCl + AgNO3 → AgCl↓ + HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3 https://www.youtube.com/watch?v=glrASuK3opA
И вообще, какого черта там происходит? Образование комплекса?
Попробуй составить ионное уравнение, с учётом гидролиза.
FeCl3 + H2O ⇄ Fe(OH)Cl2 + HCl
Гидролиз анальгина под действием соляной кислоты - проходит так, как на картинке.
Слева - анальгин, справа - 4–аминоантипирин.
Ну а дальше, сам смотри...
https://youtu.be/m2rRIuCTnDw
Мне тут стало интересно, что за топливо он применяет. В комментах предположили, что это смесь хлорила меди и этаноламина. Можете пояснить про это?
Хлорид меди - катализатор, этаноламин - восстановитель, стабилизированная перекись водорода - окислитель.
Потому что нет соответствующего транспортного белка? Полярные молекулы через биомемраны не проникают.
 116 Кб, 540x481
116 Кб, 540x481Ну я вот что нашел в интернете. Знаю, что глюкозо-6-фосфат не покидает клетку, но почему - не могу понять туплю, скореее всего
Обычные сахара тоже не могут сквозь мембрану проникать (т.к. липидный би-слой мембраны гидрофобный, а сахара из-за большого количества OH-групп гидрофильны), поэтому в мембране сидят транспортные белки, которые переносят сахара через мембрану. Эти белки высокоспецифичны. Очевидно, для фосфосахаров таких белков нет.
Спасибо за развернутый ответ.
из электро чайника, в котором тоже есть пластик. PE (Polyethylene) бутылка, для воды тоже воняет.
Анальгин в растворе сам по себе подвергается окислению растворенным кислородом, так что я думаю, что и железо (III) будет его окислять. Окраску, вероятно, дает комплекс 4-аминопирина, похожие комплексы даже в твердом виде выделяли, но там были основания Шиффа на основе 4-аминопирина.
 304 Кб, 580x580
304 Кб, 580x580Данные нужны для подачи на вход нейросети (погромизд, да), конкретный формат файла неважен, главное чтобы было описание структуры соединения и какого-то общего для группы соединений свойства (взрывоопасное/невзрывоопасное, антиозонант/неантиозонант и т.п.).
В гугле нашёл https://pubchem.ncbi.nlm.nih.gov/ , но хуй поймешь как оттуда что-то скочать.
Нейтрализуешь кислоту и отгоняешь хлорацетон.
Если говорить о номенклатуре, то пищевая - это NaHCO3. Na2CO3 - кальцинированная сода.
Разделение пищевая/техническая идет по составу примесей.
В пизду вашу химию!
Сука ненавижу, кипятил реакционную массу 4 часа, колба сука взяла и ёбнула. Всё нахуй разлетелось, всё засрало. Меня закидало, меня отравило, ПиЗДЕЦ БЛЯДЬ!!! Я ведь всё как обычно делал!! Ненавижу! СУКА!СУКА!!СУКА!!!
Неорганическая химия и основы физхи
Третьякова трехтомник.
Орга:
Курц Реутов,
Клейдн
Неорганическая теоретическая:
Хьюи
И решать решать решать
Сердечно благодарю. Как думаешь, у меня есть шанс за 3 месяца нормально подготовиться к олимпиадам за 10 класс, если знаний за пределами школьной программы у меня сейчас почти нет?
Как нехуй, за 3 месяца усиленного задротства можно выйти на очень хороший олимпиадный уровень. Но задрачивать придётся по-взрослому, без ай, сегодня не хочу, вот завтра точно сделаю. Просто бери и делай, без всяких ебучих не хочу, не могу, не знаю с чего начать, сегодня лень, я тупой, я ничего не понимаю, должно быть легко, а нихуя не легко, мне скучно, и прочего эмоционального мусора. Из органики в список добавь Терней, "Современная органическая химия". Только не просто читай, а конспектируй, и по максимуму решай задачи. Один этот двухтомник сделает тебя богом олимпиадной органической химии.
У тебя крайне нечёткая формулировка задачи, но я заебусь тут тебе объяснять, что не так с твоей задачей в онтологическом смысле. Начни с простого, с одного единственного свойства: температура плавления вещества. И ты охуеешь от того, насколько всё сложно, и насколько твоя нейросеть плохо справляется с задачей.
Если ты реально будешь каждый день по 5 часов задрачивать, а не ковыряться в носу, я буду за тебя очень горд, а школьная учительница по химии тебе отсосёт. Большинство олимпиадников не знают главного секрета - просто брать и хуярить, систематически, с задором, прочитывая и решая учебники от корки до корки. Уж поверь бывшему олимпиаднику с медалью с межнара.
Спасибо за советы, буду стараться. Можешь, если не затруднит, оставить почту или тг? На случай если вопросы будут
Да и pKa как нехуй посчитать, и много других вещей. А ты вот температуру плавления посчитай.
Если исследуемые свойства не завязаны на температуру плавления, то зачем ее считать? Это, конечно, интересно, но она сильно зависит от взаимодействия молекул друг с другом, поэтому одной структурной формулы для предсказания будет мало.
>Это, конечно, интересно, но она сильно зависит от взаимодействия молекул друг с другом, поэтому одной структурной формулы для предсказания будет мало.
Во, ты начинаешь что-то понимать. А теперь внимательно перечитай вопрос этого >>38114 анона. Далеко не везде и не всегда можно построить гипотезу достаточной предсказательной силы, если исходить только из наивной структурной формулы.
Ну так есть только один способ проверить, сработает или нет - сделать. Особенно, если это какой-нибудь курсач по МАШИН ЛЕРНИНГ, там вообще поебать на результат может быть.
Причем тут химия то нахуй? Просто повысился цельсий-другой, дошло до предела, вот и ебнуло. А шо кипятил то кстате?
Как вообще может ебнуть колба, сообщающаяся с атмосферой? Только из-за дефекта или перегретого раствора. Чтобы допустить оба варианта, надо сильно постараться. Остается еще вариант наличия взрывоопасных примесей, но его тоже легко не допустить. У меня за все годы ровно одна колба при нагревании взорвалась (точнее, вскипал перегретый растворитель), потому что прерывал перегонку и забыл досыпать свежих кипелок.
Мне нужно разделить молекулы на какие-либо два класса, т.к. предложенная нейросеть может разделять только на два класса.
Как лучше эти два класса сформулировать? Температура плавления от абсолютного нуля до нуля по Цельсию (первый) и от нуля по Цельсию до бесконечности (второй)?
Результат распознавания мне не так сильно важен, но лучше конечно чтобы был поточнее.
Тестовую выборку планирую доставать отсюда, если что т.к. есть удобный формат выгрузки, внятного поиска по каким-то свойствам только нет, только полнотекстовый - http://www.chemspider.com/FullSearch.aspx
Химия - это наука, хоть и допускающая просчеты, но все же, точность любит. Так что внешние факторы надо учитывать с полной ответственностью.
Воо, умница, теперь мы с тобой говорим по делу. Теперь такой вопрос: какого размера обучающая выборка тебе нужна для твоей задачи? Не, я понимаю что вы, программисты, можете без проблем обучить свои сетки на терабайтах картинок, но у химиков всё достаточно плохо в плане обучающей выборки - максимум пара десятков миллионов соединений с достаточно точно установленными свойствами, а всё остальное так, на глазок. ChemSpider действительно лучшее, что ты найдёшь. ПубКем тоже очень крут. Остальные источники за большие деньги, и анально отгорожены от data mining-а. Я тебе рекомендую сфокусироваться исключительно на органических соединениях, содержащих до 20-30 атомов углерода, и состоящих лишь из C, H, N, O, S, Cl, F, Br, P. А то и вовсе лишь из C, H, N, O. Или просто C, H - даже этого должно хватить. Структуру можешь скармливать своей сети в виде simplified molecular-input line-entry system (SMILES), ничего более вменяемого не придумано. Если стоит задача забацать бинарный классификатор, то выбирай либо температуру плавления, либо температуру кипения (второе может быть чуть проще, но хз). Границу лучше провести где-то в диапазоне между 0 и 100 по Цельсию, но точное значение я тебе не скажу. Для начала просто построй гистограмму распределения признака в твоей выборке, а там уже будет более или менее понятно, где именно провести границу раздела между группами.
Ну или можно попытаться ответить на простой вопрос: "является ли Х при комнатной температуре жидкостью, или твёрдым веществом?". Достаточно интуитивная формулировка.
50 веществ активного класса + 50 веществ неактивного хватит для обучающей выборки. Ну и по 10 для тестовой выборки.
Я планирую просто вытащить их с ChemSpider'a массовой SDF-выгрузкой (там есть такая опция для зарегистрированных пользователей). Времени на всякий анализ выборки и прочее нет, сдавать какой-то минимальный результат надо уже завтра чтоб не отчислили.
В общем наверно скачаю по полтиннику молекул с температурой плавления меньше и больше комнатной температуры. По остальным свойствам поиск на ChemSpider'е корявый, полнотекстовый выдает всякую хуйню, а поиск по аппрувнутым тегам (например "explosive") выдает всего по 3-4 молекулы. Ещё был вариант с "flammable" (достаточно большая выборка), но с температурой наверно получше будет?
В виде графа. Буду преобразовывать молекулу в раскрашенный граф на основе атомных дескрипторов и связей. Там не совсем обычная нейросеть.
Прикол в том, что с тобой может сыграть злую шутку то, что сами связи в молекулах, это довольно воображаемая вещь.
пишут вроде как 20 литров дают 3квтч тепла, это че, 10 баллонов за 30 тыщ которые за 20 лет не потеряют товарного вида наполнить газом Брауна от электролиза и будет 60квч*ч батарея неубиваемая? я ту-туру или это лучше лития в раз 20 без деградации?
Произойдет рекомбинация радикалов в молекулы, т.к. радикалы термодинамически нестабильны. А еще при попытке сжать водород-кислородную смесь произойдет взрыв.
>Есть CCDC, и она, вроде, есть в общем доступе.
По факту нету её в общем доступе. Там можно попросить одну-две-три структуры по мейлу, процесс намеренно максимально усложнён. А вот коммерческая версия CCDC действительно очень удобна для поиска.
Вопрос:
Можно ли наковырять лития из литола? Прочитал состав там написано литиевое мыло. Оно же стеарат лития и жиры и масла.
В теории это фигню можно окислить и получить оксид лития и всякое говнище. Дальше тудым-сюдым и опаньки литий. Учитывая что тюбик стоит 40р или сколько там, а например литиевая батарейка где 5г лития стоит 250 выглядит бюджетненько. Кто что думает?
Чистое теоретический вопрос.
> соединяться в молекулы, особен
А если сжижать? кстати каков объем сжиженного водорода например в сравнении с этим баллоном в 40 литров с 6 кубометров водорода
 55 Кб, 462x396
55 Кб, 462x396>при 100%-ом выходе
Я тебя понил. Так и думал что есть подвох такого плана, но считать быдло лень.
Непосредственная токсичность MTBE не очень высокая, но он обладает подтвержденным канцерогенным эффектом. Тефлоны устойчивы к простым алкиловым эфирам.
алсо, вся эта инфа находится гуглом за 5 минут
бля, а я 3 минуты искал(((
Провёл обучение нейросети на выборке веществ по агрегатному состоянию при комнатной температуре - как выяснилось, подобная выборка не подходит из-за, во-первых, слишком разных веществ, входящих в одну категорию выборки (например твёрдыми при комнатной температуре будут считаться как вещества, плавящиеся при +30С, так и вещества, плавящиеся при +500С), а во-вторых из-за слишком большого числа цепей в формулах (графах) тугоплавких веществ по сравнению с легко плавящимися (особенность нейросети).
Анон, подскажи, есть ли какие-нибудь два свойства вещества, для которых наличие одного исключает наличие другого?
Я пытался искать вещества с _отсутствием_ какого-либо свойства (например "explosive"/"not explosive"), но как я понимаю в химии как правило доказывают только наличие свойства у вещества, а не его отсутствие. Поэтому поиск для негативной выборки ("not explosive", "not flammable") на http://www.chemspider.com/FullSearch.aspx как правило возвращает не более 10 веществ.
С меня результаты работы нейросети, если кому-то будет интересно.
>твёрдыми при комнатной температуре будут считаться как вещества, плавящиеся при +30С, так и вещества, плавящиеся при +500С
Именно поэтому тебе выше предлагали строгие ограничения на структуру соединения:
>рекомендую сфокусироваться исключительно на органических соединениях, содержащих до 20-30 атомов углерода, и состоящих лишь из C, H, N, O, S, Cl, F, Br, P. А то и вовсе лишь из C, H, N, O. Или просто C, H - даже этого должно хватить.
Ещё раз: при правильном формировании обучающей выборки, тебе этого более чем хватит. Нафталин при комнатной температуре твёрдый, н-декан - жидкость. Вот и возьми соединения с составом C6-С14Hn, например.
> во-вторых из-за слишком большого числа цепей в формулах (графах) тугоплавких веществ по сравнению с легко плавящимися (особенность нейросети)
Не очень понял этот пассаж. Можешь пояснить ещё раз для тупых? Структуры тугоплавких веществ слишком сложные для твоей сети? Если так, то бери границу "газ/жидкость", а не "жидкость/твёрдое". Там, например, будешь различать 2,2-диметилпропан и н-пентан.
 80 Кб, 716x800
80 Кб, 716x800Нагреванием.
Шалом, двач-химикач.
У меня есть вопрос: может ли карбонильная группа связывать кислоты Льюиса, выступая, соответственно, его основанием?
И почему не может, если не может?
Шалом, двач-химикач.
У меня есть вопрос: может ли карбонильная группа связывать кислоты Льюиса, выступая, соответственно, его основанием?
И почему не может, если не может?
Но ведь галогенированные кетоны вступают в того же Фриделя-Крафтса, где кислота Льюиса — катализатор. Почему карбонильная группа тогда не может связать катализатор, таким образом существенно уменьшая скорость реакции/сводя реакцию на нет?
Алсо, прости за тупые вопросы.
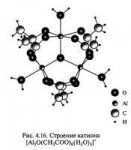 14 Кб, 427x488
14 Кб, 427x488Постоянно это делает.
У меня вопрос по колбам, но не хочу писать его в заведомо дохлый тред.
Ладно, похуй, сам перекатил.
ПЕРЕКАТ: >>438819 (OP)
ПЕРЕКАТ: >>438819 (OP)
ПЕРЕКАТ: >>438819 (OP)
ПЕРЕКАТ: >>438819 (OP)
ПЕРЕКАТ: >>438819 (OP)
ПЕРЕКАТ: >>438819 (OP)
Запросто. Более того, это является стадией известных реакций наподобие альдольно-кротонового сочетания и восстановления по Ицуно-Кори.
Это копия, сохраненная 8 июня 2018 года.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
![0fa6b4fddf2e3facdf00a9775b3d3ed1[1].jpg](/sci/big/thumb/424574/15101422349720s.jpg)




![fullICu2CO3[1].jpg](/sci/big/thumb/424574/15159040479300s.jpg)




![CaveoftheCrystals-5[1].jpg](/sci/big/thumb/424574/15169462770190s.jpg)
![CaveoftheCrystals-2[1].jpg](/sci/big/thumb/424574/15169462770201s.jpg)


![10929551-o[1].jpg](/sci/big/thumb/424574/15178561961720s.jpg)
![2497633-5[1].jpg](/sci/big/thumb/424574/15178561961731s.jpg)
![dyECSbEP18s[1].jpg](/sci/big/thumb/424574/15178626725730s.jpg)

![img40[1].jpg](/sci/big/thumb/424574/15179677962000s.jpg)
![image073[1].png](/sci/big/thumb/424574/15179677962011s.jpg)


![image300[1].gif](/sci/big/thumb/424574/15207954369321s.jpg)



![093-2[1].png](/sci/big/thumb/424574/15214652324050s.jpg)
![maxresdefault[7].jpg](/sci/big/thumb/424574/15214652324051s.jpg)
![hqdefault[2].jpg](/sci/big/thumb/424574/15214652324062s.jpg)
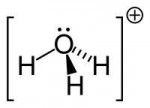


![46389599.208x208[1].jpg](/sci/big/thumb/424574/15224993304790s.jpg)
![photo-o01169273big[2].jpg](/sci/big/thumb/424574/15224993304791s.jpg)






![image006[1].png](/sci/big/thumb/424574/15254126783920s.jpg)
![image424[1].jpg](/sci/big/thumb/424574/15254126783921s.jpg)