Этого треда уже нет.
Это копия, сохраненная 4 сентября 2017 года.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
Это копия, сохраненная 4 сентября 2017 года.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.

9,9 Мб, webm, 420x236
Здрасть. Мой маленький поехавший брат смешал зеленку активиованный уголь перекись водорода Cu(OH)2 и NaF. Я, блять не ебу что получилось, но от паров меня нехило покасило. Начал задыхаться и ритм сердца сбился. Вроде сейчас все ок. Ожогов ничего нет, вроде норм. Но меня мучает интерес, че эт за хуйня была?
>>408516 (OP)
бамп блять, я в панике чуска
бамп блять, я в панике чуска

309 Кб, webm, 320x240
>>408516 (OP)
Самовнушение в основном, расслабся. Серьезно - никаких токсичных "паров" там не полетит - было интенсивное разложение перекиси - она могла создать "дым" (если перекиси много и реакция интенсивная то возможен разогрев и это буквально водяной пар) - это просто аэрозоль из капелек увлеченных компонентов смеси.
Дышать этим не полезно, конечно, но и ничего особо токсичного - там нет (никакой реакции которая могла дать токсичные соединения фтора из фторида натрия - с этими веществами, в этих условиях - не идет).
В общем классика: ПЕРЕКИСЬ + ЛЮБОЕ ГОВНО = ПАР и аэрозольное облако ЛЮБОГО ГОВНА (или продуктов его окисления).
Самовнушение в основном, расслабся. Серьезно - никаких токсичных "паров" там не полетит - было интенсивное разложение перекиси - она могла создать "дым" (если перекиси много и реакция интенсивная то возможен разогрев и это буквально водяной пар) - это просто аэрозоль из капелек увлеченных компонентов смеси.
Дышать этим не полезно, конечно, но и ничего особо токсичного - там нет (никакой реакции которая могла дать токсичные соединения фтора из фторида натрия - с этими веществами, в этих условиях - не идет).
В общем классика: ПЕРЕКИСЬ + ЛЮБОЕ ГОВНО = ПАР и аэрозольное облако ЛЮБОГО ГОВНА (или продуктов его окисления).
>>408526
бля чел, если ты такой мудрый, объясни почему зеленка больше не зеленка. А конча какая-то.
бля чел, если ты такой мудрый, объясни почему зеленка больше не зеленка. А конча какая-то.
>>408516 (OP)
CuF2 + NaOH = Cu(OH)2 + NaF;
Скорее всего - это окончательные продукты реакции, и эта реакция необратима.
Возможно, ионы меди являются катализатором разложения перикиси.
Вот бурное разложение перекиси водорода под действием аммиаката меди:
https://www.youtube.com/watch?v=vWcP5M3Vhtg
Но гидроксид меди не растворим в воде, и не диссоциирует, а если и диссоциирует, то слабо.
Возможно, при разложении перекиси гидроксид меди окисляется до гидроксида куприла(III),
но он тоже нерастворим, или возможно, растворим чуток больше...
При окислении гидроксида меди кислородом, который выделяется при разложении перикиси,
может выпадать осадок оксида меди, растворимость которого лень смотреть.
Фторид натрия - растворим, и диссоциирует:
NaF + H2O -> [Na(H2O)4]+ + F-
При этом, анион фтора обратимо взаимодействует с водой, с образованием плавиковой кислоты:
F- + H2O ⇄ HF + OH-
Плавиковая кислота может вступать в реакцию с гидроксидом меди:
Cu(OH)2 + HF -> CuF2 + H2O
Вот ещё, нашёл:
В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O.
2H2O2 -> 2H2O + O2.
Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками.
Медь является переходным металлом, значит её ионы - тоже-таки являются катализатором.
Растворимость фторида меди - не знаю, но так как это соль, а соли, как правило растворимы - то полагаю, что да.
Вижу в википедии написано, что фторид меди гигроскопичен...
Короче, ион меди в перикись, вот тебе и...
CuF2 + NaOH = Cu(OH)2 + NaF;
Скорее всего - это окончательные продукты реакции, и эта реакция необратима.
Возможно, ионы меди являются катализатором разложения перикиси.
Вот бурное разложение перекиси водорода под действием аммиаката меди:
https://www.youtube.com/watch?v=vWcP5M3Vhtg
Но гидроксид меди не растворим в воде, и не диссоциирует, а если и диссоциирует, то слабо.
Возможно, при разложении перекиси гидроксид меди окисляется до гидроксида куприла(III),
но он тоже нерастворим, или возможно, растворим чуток больше...
При окислении гидроксида меди кислородом, который выделяется при разложении перикиси,
может выпадать осадок оксида меди, растворимость которого лень смотреть.
Фторид натрия - растворим, и диссоциирует:
NaF + H2O -> [Na(H2O)4]+ + F-
При этом, анион фтора обратимо взаимодействует с водой, с образованием плавиковой кислоты:
F- + H2O ⇄ HF + OH-
Плавиковая кислота может вступать в реакцию с гидроксидом меди:
Cu(OH)2 + HF -> CuF2 + H2O
Вот ещё, нашёл:
В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O.
2H2O2 -> 2H2O + O2.
Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками.
Медь является переходным металлом, значит её ионы - тоже-таки являются катализатором.
Растворимость фторида меди - не знаю, но так как это соль, а соли, как правило растворимы - то полагаю, что да.
Вижу в википедии написано, что фторид меди гигроскопичен...
Короче, ион меди в перикись, вот тебе и...
>конча какая-то
>>408516 (OP)
CuF2 + NaOH = Cu(OH)2 + NaF;
Скорее всего - это окончательные продукты реакции, и эта реакция необратима.
Возможно, ионы меди являются катализатором разложения перикиси.
Вот бурное разложение перекиси водорода под действием аммиаката меди:
https://www.youtube.com/watch?v=vWcP5M3Vhtg
Но гидроксид меди не растворим в воде, и не диссоциирует, а если и диссоциирует, то слабо.
Возможно, при разложении перекиси гидроксид меди окисляется до гидроксида куприла(III),
но он тоже нерастворим, или возможно, растворим чуток больше...
При окислении гидроксида меди кислородом, который выделяется при разложении перикиси,
может выпадать осадок оксида меди, растворимость которого лень смотреть.
Фторид натрия - растворим, и диссоциирует:
NaF + H2O -> [Na(H2O)4]+ + F-
При этом, анион фтора обратимо взаимодействует с водой, с образованием плавиковой кислоты:
F- + H2O ⇄ HF + OH-
Плавиковая кислота может вступать в реакцию с гидроксидом меди:
Cu(OH)2 + HF -> CuF2 + H2O
Вот ещё, нашёл:
В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O.
2H2O2 -> 2H2O + O2.
Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками.
Медь является переходным металлом, значит её ионы - тоже-таки являются катализатором.
Растворимость фторида меди - не знаю, но так как это соль, а соли, как правило растворимы - то полагаю, что да.
Вижу в википедии написано, что фторид меди гигроскопичен...
Короче, ион меди в перикись, вот тебе и...
CuF2 + NaOH = Cu(OH)2 + NaF;
Скорее всего - это окончательные продукты реакции, и эта реакция необратима.
Возможно, ионы меди являются катализатором разложения перикиси.
Вот бурное разложение перекиси водорода под действием аммиаката меди:
https://www.youtube.com/watch?v=vWcP5M3Vhtg
Но гидроксид меди не растворим в воде, и не диссоциирует, а если и диссоциирует, то слабо.
Возможно, при разложении перекиси гидроксид меди окисляется до гидроксида куприла(III),
но он тоже нерастворим, или возможно, растворим чуток больше...
При окислении гидроксида меди кислородом, который выделяется при разложении перикиси,
может выпадать осадок оксида меди, растворимость которого лень смотреть.
Фторид натрия - растворим, и диссоциирует:
NaF + H2O -> [Na(H2O)4]+ + F-
При этом, анион фтора обратимо взаимодействует с водой, с образованием плавиковой кислоты:
F- + H2O ⇄ HF + OH-
Плавиковая кислота может вступать в реакцию с гидроксидом меди:
Cu(OH)2 + HF -> CuF2 + H2O
Вот ещё, нашёл:
В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O.
2H2O2 -> 2H2O + O2.
Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками.
Медь является переходным металлом, значит её ионы - тоже-таки являются катализатором.
Растворимость фторида меди - не знаю, но так как это соль, а соли, как правило растворимы - то полагаю, что да.
Вижу в википедии написано, что фторид меди гигроскопичен...
Короче, ион меди в перикись, вот тебе и...
>конча какая-то
>>408586
Также применяется, как pH-индикатор для микроскопии; с переходом от зелёного при pH 0,1 к жёлтому при pH 2,6 (нейтрализация электроноакцепторного хромофора в щелочной среде приводит к переходу окраски в сторону более длинных волн, при рН 7 окраска вновь зелёная в связи с влиянием аниона).
https://www.youtube.com/watch?v=sR5ByhoxNgk
Также применяется, как pH-индикатор для микроскопии; с переходом от зелёного при pH 0,1 к жёлтому при pH 2,6 (нейтрализация электроноакцепторного хромофора в щелочной среде приводит к переходу окраски в сторону более длинных волн, при рН 7 окраска вновь зелёная в связи с влиянием аниона).
https://www.youtube.com/watch?v=sR5ByhoxNgk
>>408607
Нашатырь - это хлорид аммония.
NH4Cl.
Он бесцветный или белый, со стеклянным блеском.
Безводный фторид меди это белые гигроскопические кристаллы кубической сингонии.
Образует кристаллогидрат CuF2·2H2O — светло-голубые кристаллы,
при нагревании плавится в собственной воде.
Если это фторид меди, можешь получить из него нерастворимый CaF сыпнув туда Ca(OH)2 и нагрев при необходимости.
Ну или разложив его при 100 градусах:
CuF2 + H2O -> CuO + 2HF
а фтороводород подав на негашённую известь,
и т. к. гидроксид кальция больше растворим чем фторид кальция - последний выпадет в осадок,
а гидроксид будет вымыт водой оттуда.
>нашатырь
Нашатырь - это хлорид аммония.
NH4Cl.
Он бесцветный или белый, со стеклянным блеском.
>фторид меди
Безводный фторид меди это белые гигроскопические кристаллы кубической сингонии.
Образует кристаллогидрат CuF2·2H2O — светло-голубые кристаллы,
при нагревании плавится в собственной воде.
Если это фторид меди, можешь получить из него нерастворимый CaF сыпнув туда Ca(OH)2 и нагрев при необходимости.
Ну или разложив его при 100 градусах:
CuF2 + H2O -> CuO + 2HF
а фтороводород подав на негашённую известь,
и т. к. гидроксид кальция больше растворим чем фторид кальция - последний выпадет в осадок,
а гидроксид будет вымыт водой оттуда.
13 Кб, 300x300
>>408728
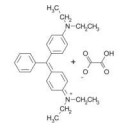
Бриллиантовый зелёный (тетраэтил-4,4-диаминотрифенилметана оксалат) — синтетический анилиновый краситель трифенилметанового ряда. Пикрелейтед.
Как видно из картинки — одним из ионов является OOCCOOH-.
HOOC-COOH - этандиовая (щавелевая) кислота, соли её - оксалаты.
Оксалат меди не растворяется в воде, образует кристаллогидрат — зелёно-голубые кристаллы.
>что по зеленки
Бриллиантовый зелёный (тетраэтил-4,4-диаминотрифенилметана оксалат) — синтетический анилиновый краситель трифенилметанового ряда. Пикрелейтед.
Как видно из картинки — одним из ионов является OOCCOOH-.
HOOC-COOH - этандиовая (щавелевая) кислота, соли её - оксалаты.
Оксалат меди не растворяется в воде, образует кристаллогидрат — зелёно-голубые кристаллы.
>>408516 (OP)
майонез аудио ПЛИС.
майонез аудио ПЛИС.
>>408516 (OP)>>408516 (OP)
Podozrevaju, 4to iz NaF obrazovalasj HF
https://ru.wikipedia.org/wiki/Плавиковая_кислота
Podozrevaju, 4to iz NaF obrazovalasj HF
https://ru.wikipedia.org/wiki/Плавиковая_кислота
P.S.: в связи с тем, что ком
>>408885
>>408888
То есть хочешь сказать, что в нормальных условиях, фторид натрия, в значимых количествах, гидролизуется до плавиковой кислоты?
А поваренная соль до соляной случайно не?
А то я суп боюсь варить.
Или это ты так 1-е апреля отмечаешь? Тогда извини.
>Podozrevaju, 4to iz NaF obrazovalasj HF
>>408888
>F- + H2O ⇄ HF + OH-
То есть хочешь сказать, что в нормальных условиях, фторид натрия, в значимых количествах, гидролизуется до плавиковой кислоты?
А поваренная соль до соляной случайно не?
А то я суп боюсь варить.
Или это ты так 1-е апреля отмечаешь? Тогда извини.
21 Кб, 297x177
1 Кб, 267x105
>>408984
Вполне...
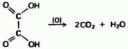
Этандиовая (щавелевая) кислота окисляется перманганатом калия, образуя диоксид углерода и воду. Пикрелейтед.
На картинке видно - это атомарный кислород от перманганата калия.
Он образуется и при разложении перикиси, пока не произойдёт реакция его молекуляризации.
Затем молекулярный кислород уже выделяется в виде газа.
И до молекуляризации, этот атомарный кислород находится в растворе.
И да, к чему же тебя приводит углекислый газ?
К нерастворимому карбонату меди CuCO3?
Вполне...
Этандиовая (щавелевая) кислота окисляется перманганатом калия, образуя диоксид углерода и воду. Пикрелейтед.
На картинке видно - это атомарный кислород от перманганата калия.
Он образуется и при разложении перикиси, пока не произойдёт реакция его молекуляризации.
Затем молекулярный кислород уже выделяется в виде газа.
И до молекуляризации, этот атомарный кислород находится в растворе.
И да, к чему же тебя приводит углекислый газ?
К нерастворимому карбонату меди CuCO3?
>>408913
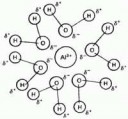
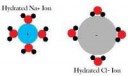
Ну не стоит верить схематичной картинке. Воды там точно больше. Если уж и Алюминий впускает к себе во внутреннюю сферу 6. то натрий точно сможет.
Ну не стоит верить схематичной картинке. Воды там точно больше. Если уж и Алюминий впускает к себе во внутреннюю сферу 6. то натрий точно сможет.
>>408999
Анион с википедии взят - статья Фторид_натрия.
Алюминаты - выглядят так:
Al(ОН)3 + NaOH = Na[Al(OH)4]
Al(ОН)3 + 3NaOH = Na3[Al(OH)6]
Заметь, в последнем 3 натрия.
Анион с википедии взят - статья Фторид_натрия.
>Если уж и Алюминий впускает к себе во внутреннюю сферу 6
Алюминаты - выглядят так:
Al(ОН)3 + NaOH = Na[Al(OH)4]
Al(ОН)3 + 3NaOH = Na3[Al(OH)6]
Заметь, в последнем 3 натрия.
>>409000
Чувак. Первая реакция неверная. Там [Al(OH)4(H2O) 2]-
Просто никто не пишет эти две воды, и да википедия плохой источник.
Чувак. Первая реакция неверная. Там [Al(OH)4(H2O) 2]-
Просто никто не пишет эти две воды, и да википедия плохой источник.
>>409107
Na2SO4·10H2O
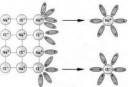
Вот ион хлорида натрия на первой пикче,
возле него 4 дипольных молекулы воды,
и 6 дипольных, вокруг него - после растворения.
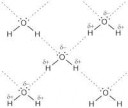
Вот тебе дельта-связи между молекулами воды, пик2, пик3,
и вот тебе ещё дельта-связи между отрицательным кислородом,
кулоновским притяжением его к заряженному иону,
по причине электроотрицательности связи О-Н.
У воды, ЭО = 3,5 - 2,1 = 1,4
https://otvet.mail.ru/question/78473372
Короче, дальше уже ничего не пойму, там в чём измеряется эта электроотрицательность,
и как она связана с зарядом иона, и как всё это с количеством молекул воды в гидратированном ионе связано...
Да и ваще впадло копать глубже...
>мирабилит
Na2SO4·10H2O
Вот ион хлорида натрия на первой пикче,
возле него 4 дипольных молекулы воды,
и 6 дипольных, вокруг него - после растворения.
Вот тебе дельта-связи между молекулами воды, пик2, пик3,
и вот тебе ещё дельта-связи между отрицательным кислородом,
кулоновским притяжением его к заряженному иону,
по причине электроотрицательности связи О-Н.
У воды, ЭО = 3,5 - 2,1 = 1,4
https://otvet.mail.ru/question/78473372
Короче, дальше уже ничего не пойму, там в чём измеряется эта электроотрицательность,
и как она связана с зарядом иона, и как всё это с количеством молекул воды в гидратированном ионе связано...
Да и ваще впадло копать глубже...
>>409120
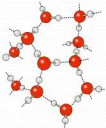
Только твои картинки это схемы, которые люди от руки рисовали. А моя это из статьи, которая получилась из рентгеноструктурного анализа. Фактически посмотрели в кристалл.
Только твои картинки это схемы, которые люди от руки рисовали. А моя это из статьи, которая получилась из рентгеноструктурного анализа. Фактически посмотрели в кристалл.
>>409126
Там у тебя кристаллогидрат, а там при растворении фторида натрия - гидратированный ион в растворе.
На первой пикче - и первое и второе.
Принцип связи иона с молекулами воды - на трех последующих пикчах.
Это дельта связи.
Там у тебя кристаллогидрат, а там при растворении фторида натрия - гидратированный ион в растворе.
На первой пикче - и первое и второе.
Принцип связи иона с молекулами воды - на трех последующих пикчах.
Это дельта связи.
>>409128
Ты пытаешься меня троллить? Я типа химик. Я просто говорю о том, что в воде ион натрия имеет 6 ближайших соседей в виде молекул воды. А картинки которые ты кидаешь они просто схематичные только для наглядного примера ион-дипольного взаимодействия. Меня смутило что в расстворе у натрия нарисовали 4 "соседа".
Ты пытаешься меня троллить? Я типа химик. Я просто говорю о том, что в воде ион натрия имеет 6 ближайших соседей в виде молекул воды. А картинки которые ты кидаешь они просто схематичные только для наглядного примера ион-дипольного взаимодействия. Меня смутило что в расстворе у натрия нарисовали 4 "соседа".
>>409130
Ой блин, чтоб проверить это надо знать сольватное число растворителя, а именно - воды,
в сольватной оболочке аквакомплекса гидратированного иона, образующегося при гидратации катионов натрия. Пик2.
И да, в кристаллогидрате мирабилита, понятно, что возле натрия не 6 молекул воды,
ион натрия там маленький такой, в том сульфате, по сравнению с сульфат-анионом и ещё и один,
ну как он может стягивать на себя аж 6 молекул воды из 10?
В растворе, быть может, но сольватная оболочка сульфат-иона будет больше,
и суммарное число молекул воды в гидратированных ионах - соответственно возрастёт.
>в воде ион натрия имеет 6 ближайших соседей в виде молекул воды
Ой блин, чтоб проверить это надо знать сольватное число растворителя, а именно - воды,
в сольватной оболочке аквакомплекса гидратированного иона, образующегося при гидратации катионов натрия. Пик2.
И да, в кристаллогидрате мирабилита, понятно, что возле натрия не 6 молекул воды,
ион натрия там маленький такой, в том сульфате, по сравнению с сульфат-анионом и ещё и один,
ну как он может стягивать на себя аж 6 молекул воды из 10?
В растворе, быть может, но сольватная оболочка сульфат-иона будет больше,
и суммарное число молекул воды в гидратированных ионах - соответственно возрастёт.
>>409134
Проблема сольватных чисел, что они учитывают среднее количество молекул воды, причем если вода в катионе лабильна, то число наоборот занижено будет. И даже те которые во второй и третьей и четвертой сфере. И это скорее коэфф для подгона красивых формул в моделях. А по поводу 6 воды в мирабилите, посмотри сам на картинку, там вода мостиковая, причем соединяется и с натрием,и с сульфатом, и с другим натрием. Я не утверждаю что в растворе 6 100%. Но точно не 4.
Проблема сольватных чисел, что они учитывают среднее количество молекул воды, причем если вода в катионе лабильна, то число наоборот занижено будет. И даже те которые во второй и третьей и четвертой сфере. И это скорее коэфф для подгона красивых формул в моделях. А по поводу 6 воды в мирабилите, посмотри сам на картинку, там вода мостиковая, причем соединяется и с натрием,и с сульфатом, и с другим натрием. Я не утверждаю что в растворе 6 100%. Но точно не 4.
Тред утонул или удален.
Это копия, сохраненная 4 сентября 2017 года.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.
Это копия, сохраненная 4 сентября 2017 года.
Скачать тред: только с превью, с превью и прикрепленными файлами.
Второй вариант может долго скачиваться. Файлы будут только в живых или недавно утонувших тредах. Подробнее
Если вам полезен архив М.Двача, пожертвуйте на оплату сервера.